
下列离子组在给定条件下离子共存判断及反应的离子方程式均正确的是
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源:2014-2015学年浙江省高三第一次五校联考化学试卷(解析版) 题型:填空题
(12分)(1)氧元素的氢化物除H2O外,还有H2O2;碳元素的氢化物除CH4外,还有C2H6;氮元素的氢化物除NH3外,还有含2个氮原子的分子的化学式为 ,其沸点比氨气 (填“高”或“低”),该氢化物与足量盐酸反应的化学反应方程式为 。
(2)类似于碳原子,氮原子间也可形成链状结构。某链状结构氮氢化合物中,氮原子间只以N-N单键形式连接形成氢化物。该系列氮氢化合物化学通式为 (n表示氮原子个数)。
(3)生活中广泛使用烃类物质(CmHn)燃料,火箭发射时的高能燃料常用氮氢化合物,比如肼N2H4。2014年10月31日在测试飞行时坠毁的维珍银河公司“太空船2号”商业载人飞船用N2H4燃料,但助燃剂选择不当据说是事故原因之一。经分析该助燃剂分子由氮、氧原子组成,分子中原子最外层电子总数和CO2分子中原子最外层电子总数相同。该助燃剂的化学式为 。上述燃烧反应产物绿色、环保,书写该燃烧反应的化学方程式为 。
(4)分子式为N4的氮元素同素异形体,结构等同于白磷,N4中每个原子满足最外层8e-结构。则1molN4中含有 对共用电子对。已知NH3、-NH2、 、
、 一定条件下都可以和H+结合。则N4和足量的H+反应生成的粒子的化学式为 。化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为 。
一定条件下都可以和H+结合。则N4和足量的H+反应生成的粒子的化学式为 。化学家发现一种化学式为N4H4的离子化合物,一定条件下1mol N4H4熔融电离生成两种离子,其中一种为NH4+,则该物质熔融时的电离方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三12月月考化学试卷(解析版) 题型:选择题
化学与生产、生活密切相关。下列说法正确的是
A.对“地沟油”进行分馏可以获得汽油发动机的燃料
B.用纯碱制玻璃、用铁矿石炼铁都会产生温室气体
C.海水中有大量人类需要的物质,可以大量开发海水中的物质,以解决资源短缺的问题
D.工业上以氯气和澄清石灰水为原料制造漂白粉
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列实验操作中正确的是

A.图甲所示,可得到干燥的氢气
B.图乙所示,可以验证氯气的漂白性
C.图丙所示,可以验证SO2的漂白性
D.图丁所示,若石灰水变浑浊,证明混合气体中一定含有CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省新余市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(14分)汽车尾气中的主要污染物是NO和CO。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
(1)2NO(g)+2CO(g)≒2CO2(g)+N2(g) △H=-746.5KJ/mol (条件为使用催化剂)
已知:
2C (s)+O2(g)≒2CO(g) △H=-221.0KJ/mol
C (s)+O2(g)≒CO2(g) △H=-393.5KJ/mol
则N2(g)+O2(g)=2NO(g)△H= kJ·mol-1。
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
C(NO)10-4 mol/L | 10.0 | 4.50 | C1 | 1.50 | 1.00 | 1.00 |
C(CO)10-3 mol/L | 3.60 | 3.05 | C2 | 2.75 | 2.70 | 2.70 |
①c1合理的数值为 。(填字母标号)
A.4.20 B.4.00 C.3.50 D.2.50
②前2s内的平均反应速率v(CO2)= 。
③不能作为判断该反应达到平衡状态的标志是 。(填字母标号)
a.
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如下图所示:

实验 编号 | T/oC | NO初始浓 度/10-3mol·L-1 | CO初始浓 度/10-3mol·L-1 | 催化剂的比 表面积/m2·g-1 |
① | 350 | 1.20 | 5.80 | 124 |
② | 280 | 1.20 | 5.80 | 124 |
③ | 280 | 1.20 | 5.80 | 82 |
则曲线Ⅰ、Ⅱ、Ⅲ对应的实验编号依次为 。
(4)已知:CO通入新制的银氨溶液中可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体。某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气体通入足量新制的银氨溶液中,生成43.2g Ag,则该温度下,反应2NO(g)+2CO(g)≒2CO2(g)+N2(g)(条件为使用催化剂)的化学平衡常数K= 。
(5)CO可作燃料电池的燃气。用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650oC下工作的燃料电池。该电池总反应方程式为2CO+O2=2CO2则负极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:填空题
(12分)【选做题】本题包括A、B两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A小题评分。
A.[物质结构与性质]
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(SCN)3等。
(1)Fe2+基态核外电子排布式为 。
(2)科学研究表明用TiO2作光催化剂可将废水中CN-转化为OCN-、并最终氧化为N2、CO2。OCN-中三种元素的电负性由大到小的顺序为 。
(3)与CN-互为等电子体的一种分子为 (填化学式);1mol Fe(CN)63-中含有σ键的数目为 。
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于 (填晶体类型)。
(5)铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。已知小立方体如图所示。

该合金的化学式为 。
B.[实验化学]
工业上常用水杨酸与乙酸酐反应制取解热镇痛药阿司匹林(乙酰水杨酸)。
【反应原理】

【物质性质】
试剂 | 沸点(℃) | 溶解度 | 化学性质 |
水杨酸 | 211 | 微溶于冷水,易溶于热水 | |
乙酸酐 |
| 在水中逐渐分解 | |
乙酰水杨酸 | 微溶于水 | 与碳酸钠反应生成水溶性盐 |
【实验流程】
(1)物质制备:向125 mL的锥形瓶中依次加入4 g水杨酸、10 mL乙酸酐(密度为1.08g/mL)、0.5 mL浓硫酸,振荡锥形瓶至水杨酸全部溶解,在85℃~90℃条件下,用热水浴加热5~10 min。
①加入水杨酸、乙酸酐后,需缓慢滴加浓硫酸,否则产率会大大降低,其原因是 。
②控制反应温度85℃~90℃的原因 。
(2)产品结晶:取出锥形瓶,加入50 mL蒸馏水冷却。待晶体完全析出后用布氏漏斗抽滤,再洗涤晶体,抽干。简要叙述如何洗涤布氏漏斗中的晶体? 。
(3)产品提纯:将粗产品转移至150 mL烧杯中,向其中慢慢加入试剂X并不断搅拌至不再产生气泡为止。进一步提纯最终获得乙酰水杨酸3.6 g。
①试剂X为 。
②实验中乙酰水杨酸的产率为 (已知:水杨酸、乙酰水杨酸的相对分子质量分别为138和180)。
(4)纯度检验:取少许产品加入盛有5 mL水的试管中,加入1~2滴FeCl3溶液,溶液呈浅紫色,其可能的原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
向20mL 0.1mol/L NH4HSO4溶液中滴入0.1mol/L NaOH溶液至恰好反应完全,下列说法正确的是
A.整个反应过程中:c(H+) + c(Na+) + c(NH4+)=c(OH-) + 2c(SO42-)
B.当滴入30mL NaOH溶液时(pH>7):c(NH4+)>c(NH3·H2O)>c(OH-)>c(H+)
C.当滴入20mL NaOH溶液时:2c(SO42-)=c(NH3·H2O)+ c(NH4+)
D.当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)= c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
(14分)氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:

(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图(a、b均大 于0),且已知: 2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-c kJ·mol-1(c>0),请写出CO将NO2还原至N2时的热化学方程式 ;
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示)。已知三个条件下起始加入浓度均为:c(N2)=0.1mol·L-1, c(H2)=0.3mol·L-1;
合成氨的反应:N2(g)+3H2(g) 2NH3(g) △H< 0
2NH3(g) △H< 0
①计算在a达平衡时H2的转化率为 ;
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是 ; 试写出判断b与a条件不同的理由 ;
(3)利用图2中c条件下合成氨(容积固定)。已知化学平衡常数K与温度(T)的关系如 下表:
T/(K) | 298 | 398 | 498 | …… |
K | 4.1×106 | K1 | K2 | …… |
①试确定K1的相对大小,K 1 4.1× 106(填写“>”“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母)。
A.容器内NH3的浓度保持不变 B.2υ( N2)正= υ( H2)逆
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示 ) 。
②25℃时,将pH =x氨水与pH =y的硫酸(且x + y = 14, x > 11 )等体积混合后,所得溶液中各种离子的浓度关系正确的是
A.c(SO42-)>c(NH4+)>c(H+)>c(OH-) B.c(NH4+)>c(SO42-)>c(OH-)>c(H+)
C.c(NH4+)+c(H+)>c(SO42-)+c(OH-) D.c(NH4+)>c(SO42-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
下列各组离子一定能够大量共存的是
A.使紫色石蕊变红的溶液:Fe2+、Mg2+、NO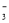 、C1-
、C1-
B.含有较多A13+的溶液:SO42-、Na+、Mg2+、NO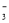
C.含有较多Fe3+的溶液:Na+、SO42-、SCN-、CO32-
D.无色透明的酸性溶液:MnO4—、K+、C1-、HCO3—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com