
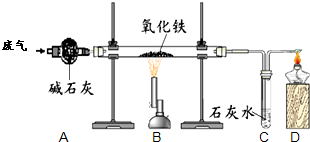
 某课外小组的同学收集了含水蒸气、一氧化碳和二氧化碳的废气,为确认这种废气中存在CO,他们在实验室按如图所示装置进行实验〔气体通过装置A速度很慢,假设在此处发生的反应完全;碱石灰(CaO和NaOH的混合物)过量〕.
某课外小组的同学收集了含水蒸气、一氧化碳和二氧化碳的废气,为确认这种废气中存在CO,他们在实验室按如图所示装置进行实验〔气体通过装置A速度很慢,假设在此处发生的反应完全;碱石灰(CaO和NaOH的混合物)过量〕.
| ||
| ||
| ||
| 160 |
| x |
| 48 |
| 2.4g |
| 8g |
| 10g |


科目:高中化学 来源: 题型:
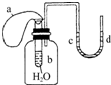 如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将观察到的现象是( )
如图所示装置,试管中盛有水,气球a盛有干燥的固体过氧化钠颗粒,U形管中注有浅红色的水,已知过氧化钠与水反应是放热的.将气球用橡皮筋紧缚在试管口,实验时将气球中的固体颗粒抖落到试管b的水中,将观察到的现象是( )| A、试管内水变为红色 |
| B、试管内有沉淀生成 |
| C、气球a被吹大 |
| D、U形管水位d高于c |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、④②①②③ | B、①②③④ |
| C、④①②③ | D、②①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | <8.0 | 8.0~9.6 | >9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验:
为了探究“二氧化碳是否在水存在时才能和过氧化钠反应”,某课题研究小组的同学们设计了如图的实验装置,分别进行了甲、乙两次实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com