
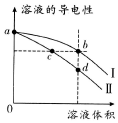
 常温下,将等体积的盐酸和氨水分别加水稀释,溶液的导电性与溶液体积的变化曲线如图所示.下列说法正确的是( )
常温下,将等体积的盐酸和氨水分别加水稀释,溶液的导电性与溶液体积的变化曲线如图所示.下列说法正确的是( )| A. | 曲线Ⅱ表示氨水加水稀释过程中溶液导电性的变化 | |
| B. | 溶液的pH大小关系:c>b>d | |
| C. | 由水电离出的n(OH- ):b>c | |
| D. | 若将b、d两点溶液混合,则:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
分析 A.常温下,将等体积的盐酸和氨水分别加水稀释,一水合氨存在电离平衡,加水稀释促进电离;
B.盐酸溶液PH小于一水合氨,稀释过程中盐酸溶液PH增大;
C.bc点是稀释不同倍数,溶液中离子浓度相同,此时氨水溶液中氢氧根离子浓度和氢离子浓度相同,一水合氨稀释程度大则水电离出的氢氧根离子浓度大;
D.稀释相同倍数,氨水溶液中氢氧根离子浓度大于盐酸溶液中氢离子浓度.
解答 解:A.图中分析可知开始导电能力相同说明开始氢氧根离子浓度和氢离子浓度相同,加水稀释促进一水合氨电离平衡正向进行,氢氧根离子浓度大于盐酸溶液中氢离子浓度,导电能力强,则曲线Ⅰ表示氨水加水稀释过程中溶液导电性的变化,故A错误;
B.盐酸溶液PH小于一水合氨,稀释过程中盐酸溶液PH增大,溶液的pH大小关系:b>d>c,故B错误;
C.由于氨水是弱电解质,HCl是强电解质,稀释相同倍数后,氨水导电能力强,所以氨水中水的电离程度小,而b、c两点的导电能力相同,由水电离出的n(OH- ):b>c,故C正确;
D.图中分析可知开始导电能力相同说明开始氢氧根离子浓度和氢离子浓度相同,加水稀释促进一水合氨电离平衡正向进行,.稀释相同倍数,氨水溶液中氢氧根离子浓度大于盐酸溶液中氢离子浓度,若将b、d两点溶液混合c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选C.
点评 本题考查了弱电解质电离平衡的影响因素、稀释过程中溶液中离子浓度变化、溶液导电性的理解应用,掌握基础是解题关键,题目难度中等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C=O(CO2) | C=O(COS) | C=S(COS) | H-S | H-O |
| E/kJ•mol-1 | 803 | 742 | 577 | 339 | 465 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
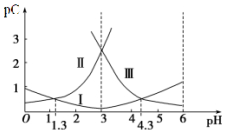
| A. | 曲线I代表HC2O4-的浓度随着pH增大先变小后变大 | |
| B. | 草酸的电离常数 Kal=l×10-1.3; Ka2=l×10-4.3 | |
| C. | pH=4时,c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | $\frac{{c({C_2}{O_4}^{2-})•c({H_2}{C_2}{O_4})}}{{{c^2}(H{C_2}{O_4}^-)}}={10^{-3}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量石灰乳吸收工业尾气中的SO2:Ca2++2OH-+SO2═CaSO3↓+H2O | |
| B. | 用酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用铜做电极电解NaCl溶液:2C1-+2 H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| D. | 将 Fe2O3 加入到 HI 溶液中:Fe2O3+6H+═2Fe3++3 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴极的电极反应式为Cu2++2e-═Cu,当有Cu2+时,Fe3+不放电 | |
| B. | 阴极上首先析出铁,然后析出铜 | |
| C. | 首先被电解的是Fe2(SO4)3溶液,后被电解的是CuSO4溶液 | |
| D. | 阴极上不可能析出铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com