
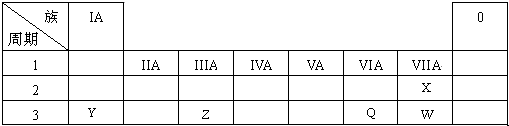
| A. | 所有主族元素原子的最外层电子数都等于元素的最高正化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较低 | |
| C. | 第IA族元素从上到下,单质的熔点逐渐降低 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
分析 A、氧和氟无正价;
B、多电子原子中,在离核较近的区域内运动的电子能量较低;
C、第1列包含氢元素与碱金属元素,同族(即同列)元素单质的熔沸点递变规律:金属从上到下逐渐降低;
D、过渡元素包含副族元素与第Ⅷ族元素.
解答 解:A、O、F无正价,故A错误;
B、多电子原子中,在离核较近的区域内运动的电子能量较低,故B正确;
C、第1列包含氢元素与碱金属元素,自上而下熔沸点先增大后降低,故C错误;
D、位于金属和非金属分界线附近的元素,表现一定的金属性与非金属性,而过渡元素包含副族元素与第Ⅷ族元素,故D错误,
故选B.
点评 本题考查结构性质位置关系的应用,难度不大,侧重对基础知识的巩固,A选项为易错点.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| HClO | Ki=3×10-8 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
| A. | c(HC03-)>c(C10- )>c(OH-) | |
| B. | c(Na+)=c(C1O-)+c(HClO) | |
| C. | c(HClO)+c(ClO-)=c(HCO3 -)+c(H2CO3)+c(CO32-) | |
| D. | (Na+)+c(H+)=c(HCO3-)+c(ClO- )+c(OH-)+2 c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q2=2Q1 | B. | Q1<0.5 Q2 | C. | Q1<Q2<184.8 kJ | D. | Q1=Q2<92.4 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小:Na>P>N | B. | 金属性强弱:K>Na>Ca | ||
| C. | 酸性强弱:H2SiO3>H2CO3 | D. | 碱性强弱:LiOH>NaOH>KOH? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温室效应--二氧化碳 | B. | 酸雨--二氧化碳 | ||
| C. | 白色污染--废塑料制品 | D. | 臭氧层破坏--氟氯代烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
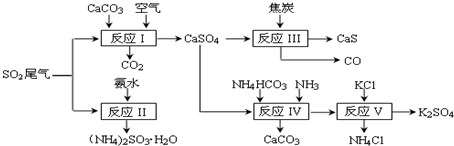
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 山梨酸不能使溴水褪色 | B. | 山梨酸中的含氧官能团为羟基 | ||
| C. | 山梨酸最多有6个碳原子共面 | D. | 山梨酸不能与NaHCO3发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com