
| A. | 加热,用湿润的红色石蕊试纸在试管口观察现象 | |
| B. | 加水溶解,用红色石蕊试纸测其溶液的酸碱性 | |
| C. | 加强碱溶液,加热,滴入酚酞试液,观察溶液颜色 | |
| D. | 加苛性钠溶液,加热,用湿润的红色石蕊试纸在试管口进行检验 |
分析 检验铵盐溶液的方法是:铵盐和氢氧化钠在加热条件下生成氨气,氨气能使湿润红色石蕊试纸会变蓝色,由原子守恒来判断为铵盐.
解答 解:A.直接加热铵盐晶体虽然也可分解产生氨气,但同时会生成其他气体,混合气体及水蒸气在到达试管口之前即又冷却化合成为原铵盐晶体附着在试管壁上,故无法使湿润红色石蕊试纸变蓝,故A错误;
B.铵盐和水混合不会产生氨气,将湿润的红色石蕊试纸放在试管中会显示红色,是因为铵根离子水解显示酸性,但是显酸性的溶液不一定是铵盐,故B错误;
C、加强碱溶液后加热,再滴入无色酚酞试液,因为强碱溶液呈碱性,不能确定是否有铵根离子,故C错误;
D.将白色固体放入试管加热,用湿润的红色石蕊试纸放在试管口,湿润红色石蕊试纸会变蓝色,证明产生的气体是氨气,则该盐中含有铵根离子,这是检验铵盐的方法,故D正确.
故选D.
点评 本题考查物质的检验,为高频考点,侧重于学生的分析、实验和评价能力的考查,注意把握物质的性质以及实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:解答题
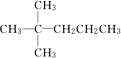 .
. 、
、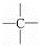 中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示.例如:
中的碳原子分别称为伯、仲、叔、季碳原子,数目分别用N1、N2、N3、N4表示.例如: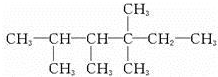
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3-CH3 | B. | CH3COOH | C. | CH3COOCH3 | D. | CH3COCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
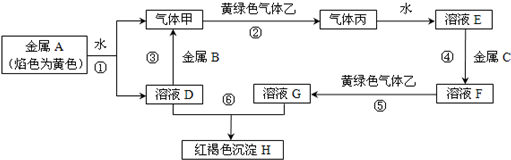
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
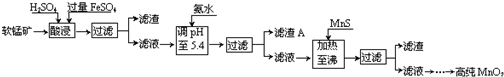
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | HCl溶液 | C. | Na2CO3溶液 | D. | NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度:c甲=2c乙 | |
| B. | 水电离出的OH-浓度:c(OH-)甲=c(OH-)乙 | |
| C. | 若分别用等浓度的NaOH溶液完全中和,所得溶液的pH:甲=乙 | |
| D. | 将甲、乙烧杯中溶液混合后(不考虑体积变化),所得溶液的pH>1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com