
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式_________。
②由上表数据可知该反应为放热反应,理由是_________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是_________。(填序号)
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
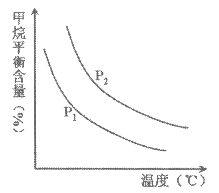
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②该反应为________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
①平衡时CO的转化率为_________。
②该温度下反应的平衡常数K值为_________。
【答案】![]()
![]()
![]() 随温度升高,反应的平衡常数K减小 a、d < 吸热 60%
随温度升高,反应的平衡常数K减小 a、d < 吸热 60% ![]() 或2.25
或2.25
【解析】
(1)①工业合成氨的化学方程式为:![]()
![]()
![]() ;
;
②对于放热反应而言,升高温度,K值减小,表中的数据表明升高温度,K值在减小,所以可以推出该反应是放热反应;
③a. 增大压强,平衡向正反应方向(气体体积减小的方向)移动移动,则H2的转化率增大,a正确;
b. 催化剂不影响平衡的移动,不会引起H2的转化率的改变,b错误;
c. 升高温度,平衡向逆反应方向(吸热反应方向)移动,则H2的转化率减小,c错误;
d. 及时分离出NH3,则NH3的浓度减小,平衡正向移动,H2的转化率增大,d正确;
故合理选项为a、d;
(2)①温度相同时,压强由P1变为P2,CH4的平衡含量升高,说明平衡逆向移动,由于该反应的逆反应是气体体积减小的反应,所以压强增大,即P1<P2;
②压强相同时,升高温度,CH4的平衡含量降低,说明平衡正向移动,则该反应是吸热反应;
(3)该反应的三段式为(单位:mol·L-1):
CO (g)+ | H2O(g) | CO2(g)+ | H2(g) | |
1 | 1 | 1 | 1 | |
起 | 0.2 | 0.2 | 0 | 0 |
转 | 0.12 | 0.12 | 0.12 | 0.12 |
平 | 0.08 | 0.08 | 0.12 | 0.12 |
①CO的转化率为![]() =60%;
=60%;
②K=![]() =
=![]() =2.25。
=2.25。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉)。请回答:

(1)仪器A的名称是________,烧瓶中反应的化学方程式是_____________________。
(2)装置B中盛放液体是___,气体通过装置B的目的是__________________,装置C中盛放的液体是_________。
(3)D中反应的化学方程式是__________________________________________。
(4)烧杯E中盛放的液体是_____,反应的离子方程式是___________。
(5)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加__装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1000mol/L的NaOH溶液分别滴加到20.00mL浓度均为0.1000mol/L的一元酸HX和HY溶液中,溶液的pH与所加NaOH体积的关系如图所示,下列叙述错误的是
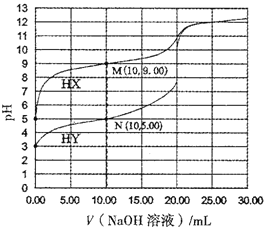
A. N点溶液中c(Y-)>c(Na+)>c(OH-)>c(H+)
B. 常温下,0.1000mol/LHY溶液的电离度约为1%
C. Ka(HX)数量级为10-9
D. 用NaOH溶液滴定HY可用酚酞做指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用图示装置制备KC1O溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。
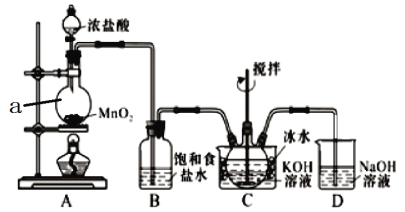
(査阅资料)① Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;② K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称是_________;装置A中反应的化学方程式为__________________。
(2)装置C中三颈烧瓶置于冰水浴中的目的是_________________________________。
(3)装置B吸收的气体是_________,装置D的作用是___________________________。
(4)C中得到足量KC1O后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为__________________________。
(5)往(4)所得溶液中加入饱和KOH溶液,冷却至0℃~5℃析出紫黑色晶体,过滤,得到K2FeO4粗产品。K2FeO4粗产品含有KCl等杂质,进一步提纯方法是___________。
(6)若实验中消耗了VmL c mol/L的Fe(NO3)3溶液,Fe(NO3)3充分反应,最终制得a g的K2FeO4固体,则本实验K2FeO4的产率为 ______________(列出算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=_________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“>”、“<” 、“=”)。
②温度为500℃时,该反应10 min时达到平衡。用H2表示该反应的反应速率v(H2)=______________;该温度下,反应I的平衡常数K=______________L2/mol2
(4)由CO2制备甲醇还需要氢气。工业上用电解法制取Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
FeO42+3H2↑,工作原理如图所示。电解一段时间后,c(OH)降低的区域在__________ (填“阴极室”或“阳极室”)。该室发生的电极反应式为:___________________________。
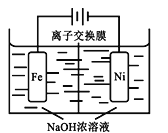
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。已知:制取氨气的反应原理为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O

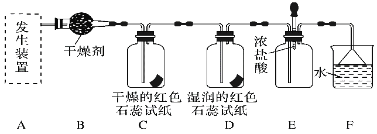
[实验探究]
(1)利用上述原理,实验室制取氨气应选用下图中________(填序号)发生装置进行实验。
(2)B装置中的干燥剂可选用________(填“碱石灰”或“浓硫酸”)。
(3)气体通过C、D装置时,试纸颜色会发生变化的是________(填“C”或“D”)。
(4)F装置中倒置漏斗的作用是___________________________________。
(5)某同学用氨气和滴加酚酞的水做喷泉实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有________性质(填序号)。
a.还原性 b.极易溶于水 c.与水反应生成碱性物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑥在表中的位置,用化学用语回答下列问题。

(1)元素①的原子结构示意图为_________。
(2)元素③和⑥可形成化合物,用电子式表示形成其过程_________。
(3)元素②、③形成简单离子的半径(填离子符号)_________>_________。
(4)元素②、⑥形成的气态氢化物稳定性(填化学式,下同)______>_______;元素③、④形成的最高价氧化物水化物的碱性_________>_________。
(5)元素④的最高价氧化物与元素⑤最高价氧化物的水化物稀溶液反应的离子方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在科学研究和工业生产中具有重要的用途。
(1)三氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示:
①此配合物中,铁离子价电子排布图为_____;
②此配离子中碳原子的杂化轨道类型为_____;
③此配离子中含有的化学键为_____。
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键 G.σ键 H.π键
(2)NO2-与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。NO2-离子的VSEPR模型名称为_____,K3[Co(NO2)6]是黄色沉淀,该物质中四种元素的电负性由大到小的顺序是_____。
(3)研究物质磁性表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2,其中适合作录音带磁粉原料的是_____。

(4)锰的一种配合物的化学式为Mn(BH4)2(THF)3,写出两种与BH4-互为等电子体的微粒_____(请写一个分子和一个离子)。
(5)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛,立方ZnS晶体的结构如图所示,a的配位数为_____,已知晶胞密度为ρ g/cm3,则相邻2个b微粒之间的距离为_____nm(列计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示的两种有机物都由碳、氢、氧三种元素组成,下列叙述不正确的是( )

A.①和②都含有官能团羟基B.①和②具有相似的化学性质
C.①和②为同系物D.①和②所含氧元素的质量分数相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com