
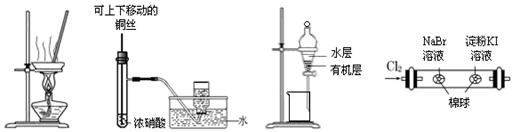
| A.用图1所示装置,蒸干AlCl3饱和溶液制备AlCl3晶体 |
| B.用图2所示装置,制备并收集少量NO2气体 |
| C.用图3所示装置,分离CCl4萃取I2水后的有机层和水层 |
| D.用图4所示装置,可以证明氧化性:Cl2>Br2>I2 |


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源:不详 题型:实验题

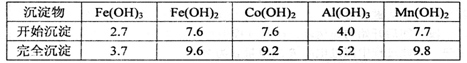

| A.2.0~2.5 | B.3.0~3.5 | C.4.0~4.5 | D.5.0~5.5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验操作 | 现象 | 解释或结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO |
| B | 等体积pH=3的HA和HB 两种酸分别与足量的锌反 应,排水法收集气体 | HA放出的氢气多且反应速率快 | HB酸性比HA强 |
| C | 在镁、铝为电极,氢氧化钠为电解质的原电池装置中 | 镁表面有气泡 | 金属活动性:Al>Mg |
| D | 向1 mL 1%的NaOH溶液中 加入2 mL 2%的CuSO4溶 液,振荡后加入0.5 mL有 机物Y,加热 | 未出现砖红色 沉淀 | Y中不含有醛基 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 MnO2+Zn+2H2SO4。
MnO2+Zn+2H2SO4。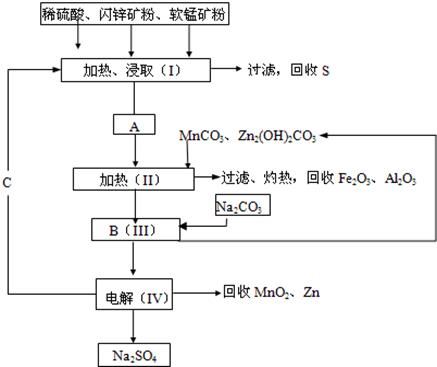
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
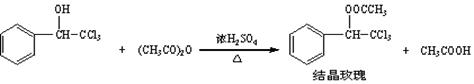
| 三氯甲基苯基甲醇 | 式量:224.5。无色液体。不溶于水,溶于乙醇。 |
| 醋酸酐 | 无色液体。溶于水形成乙酸,溶于乙醇。 |
| 结晶玫瑰 | 式量:267.5。白色至微黄色晶体。熔点:88℃。不溶于水,溶于乙醇,70℃时在乙醇中溶解度为a g。 |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇。 |

| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将粗产品溶解在 中,按粗产品、溶剂的质量比为1: 混合,用水浴加热到70℃回流溶剂使粗产品充分溶解 | 得到无色溶液 | |
| ② | 将步骤1所得溶液___________ | | |
| ③ | 干燥步骤2所得白色晶体, | __________________ | 白色晶体是结晶玫瑰 |


查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
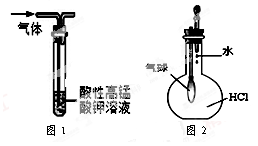
| A.用干燥pH试纸测定某新制氯水的pH |
| B.用图1装置能除去SO2中混有的CO2 |
| C.用图2装置能验证HCl气体在水中的溶解性 |
| D.用25 mL碱式滴定管量取20.00 mLKMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
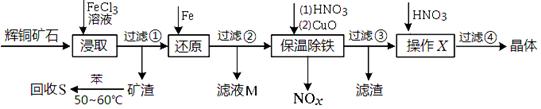
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | A | B | C | D |
| 装置 | 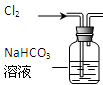 | 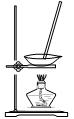 | 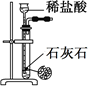 |  |
| 目的 | 除去Cl2中含有的少量HCl | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量纯净的CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
| D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com