
| A. | MgCl2 | B. | Na2O2 | C. | H2O | D. | CH4 |
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式H:Cl | B. | HClO的结构式:H-Cl-O | ||
| C. | Cl-的结构示意图: | D. | 质量数为37的氯原子:37Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2的电子式: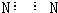 | B. | S2-的结构示意图: | ||
| C. | 次氯酸的结构式:H-O-Cl | D. | ${\;}_{40}^{65}$Zr和${\;}_{40}^{67}$Zr是同种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I元素中含中子数为53 | |
| B. | 它是碘元素的一种同位素 | |
| C. | ${\;}_{53}^{131}$I2的摩尔质量为262 g | |
| D. | 由此可确定碘元素相对原子质量为131 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2、Br2、I2的熔点 | B. | Cl2、Br2、I2的相对分子质量 | ||
| C. | HCl、HBr、HI的酸性 | D. | 氢化物HCl、HBr、HI的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
现使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).| 滴定次数 | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com