
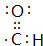 .
. .
. .
.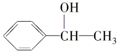 .
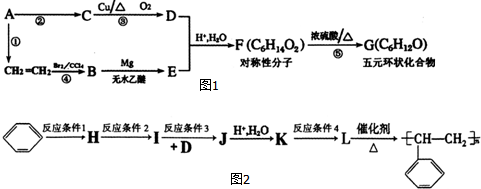
. 分析 乙烯与溴水反应生成B为BrCH2CH2Br,则E为BrMgCH2CH2MgBr,(1)中A与B具有相同的官能团,则A为CH3CH2Br,由F的分子式可知D为CH3CHO,则C为CH3CH2OH,F为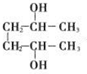 ,G为环状化合物,则G为
,G为环状化合物,则G为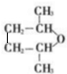 .
.
(5)苯与溴在溴化铁做催化剂条件下生成H为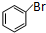 ,H与Mg/无水乙醚作用得到I为
,H与Mg/无水乙醚作用得到I为 ,再与乙醛反应、然后酸化生成K为
,再与乙醛反应、然后酸化生成K为 ,K再发生消去反应生成L为
,K再发生消去反应生成L为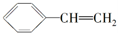 ,最后发生加聚反应得到聚苯乙烯.
,最后发生加聚反应得到聚苯乙烯.
解答 解:乙烯与溴水反应生成B为BrCH2CH2Br,则E为BrMgCH2CH2MgBr,(1)中A与B具有相同的官能团,则A为CH3CH2Br,由F的分子式可知D为CH3CHO,则C为CH3CH2OH,F为 ,G为环状化合物,则G为
,G为环状化合物,则G为 .
.
(1)在①②③④⑤反应中,①属于消去反应,②⑤属于取代反应,③属于氧化反应,④属于加成反应,属于取代反应的是②⑤,A与B具有相同的官能团,则官能团的名称是溴原子,D中所含官能团为醛基,电子式是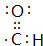 ,
,
故答案为:②⑤;溴原子;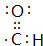 ;
;
(2)反应⑤的化学方程式: ,
,
故答案为: ;
;
(3)F为 ,用系统命名法命名为2,5-己二醇,与F具有相同的碳骨架和相同的官能团种数的,能稳定存在的同分异构体,2个羟基不连接在同一碳原子上,可以看着正己烷为2个-OH取代,利用定一移一法可知共有8种(不含F),
,用系统命名法命名为2,5-己二醇,与F具有相同的碳骨架和相同的官能团种数的,能稳定存在的同分异构体,2个羟基不连接在同一碳原子上,可以看着正己烷为2个-OH取代,利用定一移一法可知共有8种(不含F),
故答案为:2,5-己二醇;8;
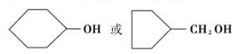
(4)G( )的一种同分异构体满足:①能与金属钠反应,说明含有羟基,②核磁共振氢谱有5个峰,峰面积比为1:1:4:4:2,满足下列条件的物质G的同分异构体:
)的一种同分异构体满足:①能与金属钠反应,说明含有羟基,②核磁共振氢谱有5个峰,峰面积比为1:1:4:4:2,满足下列条件的物质G的同分异构体: ,
,
故答案为: ;
;
(5)苯与溴在溴化铁做催化剂条件下生成H为 ,H与Mg/无水乙醚作用得到I为
,H与Mg/无水乙醚作用得到I为 ,再与乙醛反应、然后酸化生成K为
,再与乙醛反应、然后酸化生成K为 ,K再发生消去反应生成L为
,K再发生消去反应生成L为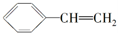 ,最后发生加聚反应得到聚苯乙烯.
,最后发生加聚反应得到聚苯乙烯.
反应条件1所选用的试剂为液溴、溴化铁,反应条件2所选用的试剂为Mg、无水乙醚,K的结构简式为  ,
,
故答案为:液溴、溴化铁;Mg、无水乙醚; .
.
点评 本题考查有机物的推断与合成,注意根据反应信息与有机物分子式进行推断,熟练掌握官能团的性质与转化,是对有机化学基础的综合考查.


科目:高中化学 来源: 题型:选择题
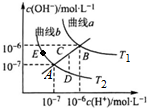
| A. | 图中温度T2>T1 | |
| B. | 曲线a、b均代表纯水的电离情况 | |
| C. | 图中五点的Kw的关系:B>C>A>D=E | |
| D. | 若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
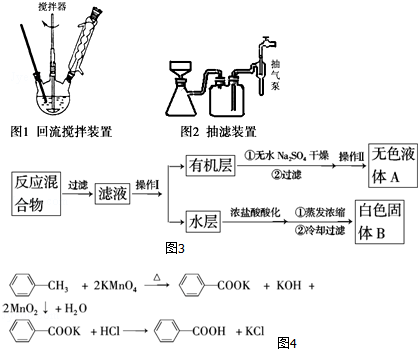
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
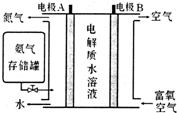
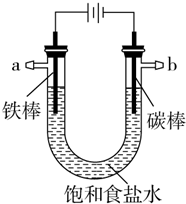 以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )
以碳棒作阴极,铁棒作阳极电解NaCl溶液,电解开始约20秒后,阳极附近略显白色浑浊,然后开始出现灰绿色浑浊,最后生成较多的红褐色沉淀.下列说法正确的是( )| A. | 阳极电极反应式:Fe-3e-═Fe3+ | |
| B. | 水被电解后析出白色浑浊物为NaCl晶体 | |
| C. | 灰绿色浑浊是Fe(OH)2 | |
| D. | 随着电解的进行,溶液逐渐由中性变成碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
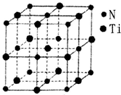 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题:
金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题: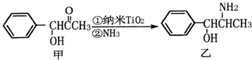
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
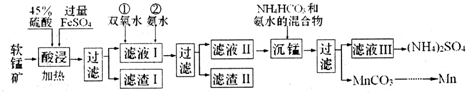
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
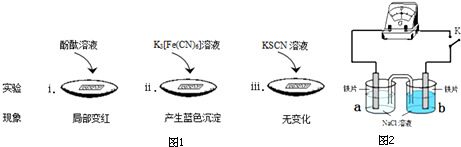
| 实验 | a | b | 指针偏转方向 |
| Ⅰ | 0.1% | 0.01% | 向右 |
| Ⅱ | 0.1% | 3.5% | 向左 |
| Ⅲ | 3.5% | 饱和溶液 | 向右 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | HR为强酸 | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | b点溶液中c( NH4+)>c( R-)、c(OH-)>c(H+) | |
| D. | a~c任意点溶液均有c(H+)×c(OH-)=Kw=l.0×l0-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓ | |
| B. | 0.3 mol FeBr2与0.4 mol Cl2在溶液中反应:8Cl2+6Fe2++10Br-=6Fe3++16Cl-+5Br2 | |
| C. | Cu与稀HNO3反应:Cu+4H++2NO3-=Cu2++2NO↑+2H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com