
科目:高中化学 来源: 题型:阅读理解
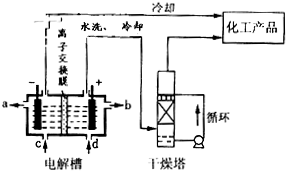
| ||
| ||
| △ |
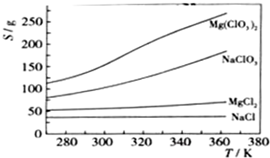
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| PH | 3.2 | 5.2 | 12.4 |
查看答案和解析>>
科目:高中化学 来源:灌云县2006-2007学年高三第一次联考、化学试卷 题型:022
(1)下列有关实验的基本操作及安全知识的叙述,正确的是________(填序号.错选倒扣分,至本小题扣完为止).
A、用干燥的pH试纸测定氯水的pH
B、用结晶法可以除去硝酸钾中混有的少量氯化钠
C、切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
D、实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
E、浓硫酸不小心沾到皮肤上,立刻用稀烧碱溶液洗涤
F、在氢氧化铁胶体中滴加少量稀硫酸不会产生沉淀
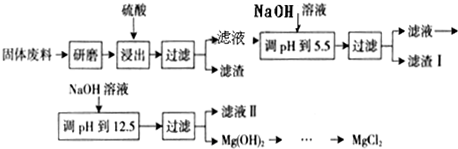
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制.某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步聚1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步聚2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步聚3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
①上述实验中的过滤操作需要烧杯、________、________等玻璃仪器.
②步聚2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为:________;
③步聚2中,判断加入BaCl2已过量的方法是:________;
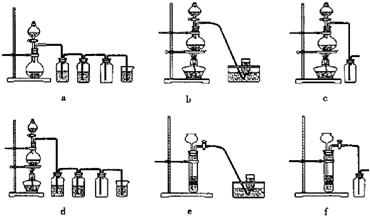
④为检验精盐纯度,需配制100mL0.2mol/LNaCl(精盐)溶液,右图是该同学转移溶液的示意图,图中的错误是________、________.
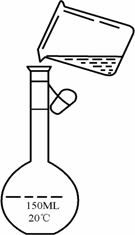
查看答案和解析>>
科目:高中化学 来源: 题型:
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐。
请回答下列问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器。
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为_______________________。
(3)步骤2中,判断加入BaCl2已过量的方法是_______________________。
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是_______
______________________________________________________。
(5)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的两处错误是:

____________________________________________________________________,
____________________________________________________________________。
若在定容时仰视,则所配溶液的浓度__________0.2 mol·L-1(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com