
X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示。若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是

A.原子半径:W>Z>Y>X
B.相等物质的量浓度的气态氢化物溶液的pH: X>Z>W
C.最高价氧化物对应水化物的酸性:Z>W>X
D.四种元素的单质中,Z单质的熔沸点最低
B
【解析】
试题分析:X、Y、Z、W均为短周期元素,Y原子的最外层电子数是内层电子数的3倍,则Y原子有2个电子层,所以Y为氧元素,根据X、Y、Z、W在周期表中相对位置可知,X为氮元素,Z为硫元素,W为氯元素。A、同周期元素的从左到右原子半径逐渐减小,则X>Y,Z>W,同主族元素从上到下原子半径逐渐增大,且原子核外电子层数越多,半径越大,则W>X,所以原子半径大小顺序为Z>W>X>Y,故A错误;B、四种元素对应的氢化物分别为NH3、H2O、H2S、HCl,其中NH3的水溶液呈碱性,H2O呈中性,H2S为弱酸,HCl的水溶液为强酸,所以相等物质的量浓度的气态氢化物溶液的pH:X>Y>Z>W,故B正确;C、同周期元素从左到右元素的非金属性逐渐增强,根据元素的非金属性越强,对应最高价氧化物的水化物的酸性越强可知最高价氧化物对应水化物的酸性:W>Z,故D错误;D、四种元素对应的单质中,S在常温下为固体,熔沸点最高,其它元素对应的单质在常温下为气体,故D错误。
考点:位置结构性质的相互关系应用


 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2014学年高一化学人教版必修2 1.2.2元素周期表周期律的练习卷(解析版) 题型:填空题
元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期表的一部分。

(1)阴影部分元素在元素周期表中的位置为________族。
(2)根据元素周期律预测:H3AsO4属于强酸还是弱酸?________。
(3)C和Si元素的氢化物都可以燃烧,但Si元素的氢化物在空气中可以自燃,其原因是_________________________________________。
试写出Si的氢化物完全燃烧的化学方程式:______________________________。
(4)O2与H2的反应是不可逆反应,而S与H2反应有一定限度,请写出Se与H2反应的化学方程式:______________________
(5)试比较S、O、F三种元素的原子半径大小:________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.2元素的性质与原子结构练习卷(解析版) 题型:选择题
下列关于卤族元素由上到下性质递变规律的叙述,正确的是( )。
①单质的氧化性增强 ②单质的颜色加深 ③气态氢化物的稳定性增强 ④单质的沸点升高 ⑤阴离子的还原性增强
A.①②③ B.②③④ C.②④⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源:2014学年高一化学人教版必修2 1.1.1元素周期表练习卷(解析版) 题型:选择题
元素周期表是学习化学的重要工具,如图是元素周期表中的一格,从该图中,我们获取的相关信息中错误的是( )。

A.该元素的名称是钠
B.该元素的原子序数为11
C.该元素的地壳中的含量为22.99%
D.该元素的元素符号为Na
查看答案和解析>>
科目:高中化学 来源:2013-2014学年黑龙江省高三上学期期末考试理综化学试卷(解析版) 题型:填空题
A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,A—J的所有物质之间有如下的转化关系(部分反应产物省略):

(1)B元素和C元素的简单离子半径大小关系是 (用离子符号表示):
(2)将氮元素与C形成的化合物NC3加入水中产生使红色石蕊试纸变蓝的气体,写出该反应的化学方程式 ;
(3)由E的饱和溶液滴入沸水中形成透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是 ;
(4)将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
;
(5)向含有0.1 mol G的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g ,则加入盐酸的体积可能为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮提分训练 专题1物质组成性质分类及化学用语练习卷(解析版) 题型:选择题
下列有关化学用语表示正确的是( )。
A.二氧化硅的分子式:SiO2
B.聚乙烯的结构简式:?CH2CH2?
C.高氯酸钠(NaClO4)中Cl元素的化合价:+6
D.Mg5(Si4O10)2(OH)2·4H2O的氧化物形式:5MgO·8SiO2·5H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:实验题
草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O可用于摄影和蓝色印刷。实验室制备草酸合铁酸钾晶体的实验流程如下:

(1)若用铁和稀硫酸制备FeSO4·7H2O,常保持______过量,理由是___________________________________________________。
(2)上述流程中,“沉淀”一步所得FeC2O4·2H2O沉淀需用水洗涤。检验沉淀是否洗涤干净的方法是_________________________________________________________________。
(3)测定草酸合铁酸钾产品中Fe3+含量和C2O42-含量的实验步骤如下:

步骤1:准确称取所制草酸合铁酸钾晶体a g(约1.5 g),配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入6 mol·L-1 HCl 10 mL,加热至70~80 ℃,趁热用SnCl2TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10 mL,在75~80 ℃下用0.010 00 mol·L-1 KMnO4标准溶液滴定至终点(Cl-不参与反应),将C2O42-全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积。
步骤3:……
步骤4:重复上述步骤2~步骤3两次。
①步骤2操作时,还需要使用如图所示仪器中的________(填序号)。
②步骤2中MnSO4溶液的作用是________,滴定终点的现象是______________________________________。
③在不增加试剂种类的前提下,步骤3的目的是_________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 高考模拟演练2练习卷(解析版) 题型:选择题
下列有关化学用语正确的是( )。
A.核内有8个中子的碳原子:
B.CS2的结构式:S—C—S
C.乙烯的比例模型: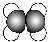
D.NH4Br的电子式:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习江苏专用 第8讲电化学练习卷(解析版) 题型:选择题
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O电解,Al2O3+3H2↑
电解过程中,以下判断正确的是( )。
电池电解池
AH+移向Pb电极H+移向Pb电极
B每消耗3 mol Pb生成2 mol Al2O3
C正极:PbO2+4H++2e-=Pb2++2H2O阳极:3Al+3H2O-6e-=Al2O3+6H+
D

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com