
分析 (1)石英坩埚主要成分为二氧化硅,碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳;
(2)向NaHCO3溶液中滴加BaCl2溶液,可观察到有白色沉淀为碳酸钡、无色气体为二氧化碳,据此书写离子方程式;
(3)根据质量守恒定律:反应前后各原子的数目不变,选择相应的配平方法(最小公倍数法、定一法等)进行配平即可.
解答 解:(1)石英坩埚主要成分为二氧化硅,碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳,该反应的化学方程式为:Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,
故答案为:Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑;
(2)向NaHCO3溶液中滴加BaCl2溶液,可观察到有白色沉淀为碳酸钡、无色气体为二氧化碳,离子方程式为:2HCO3-+Ba2+=BaCO3↓+CO2↑,
故答案为:2HCO3-+Ba2+=BaCO3↓+CO2↑;
(3)反应前Cu为+2价,反应后为+1,化合价降低1,Al化合价没有变化,所以氧元素的化合价升高,生成氧气,反应前氧为-2价,反应后为0,化合价升高2,两者的最小公倍数是2,再根据原子守恒得:4CuO+2Al2O3$\frac{\underline{\;高温\;}}{\;}$4CuAlO2+O2↑,
故答案为:4、2、4、O2.
点评 本题考查了方程式的书写,考查了学生的分析、理解信息、应用信息的能力,掌握反应原理是解答关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:多选题
| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1 CaCl2溶液等体积混合:c(Na+)+2c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-) | |
| B. | 浓度均为0.1 mol•L-1的小苏打溶液与烧碱溶液等体积混合:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| C. | pH相同的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=2c(Ba2+) | |
| D. | 常温下,0.2 mol•L-1 NH4NO3溶液与0.1 mol•L-1 NaOH溶液等体积混合,所得pH=9.6的溶液中:c(NO3-)>c(Na+)>c(NH4+)>c(NH3•H2O)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥⑦ | B. | ①②③⑥⑦ | C. | ①④⑤⑥⑦ | D. | ①②⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氯甲烷只有一种,说明甲烷分子是立体结构 | |
| B. | 2-丁烯四个碳原子共平面,说明乙烯分子是平面结构 | |
| C. | 苯乙炔分子中所有原子共平面,说明乙炔分子中原子在一条直线上 | |
| D. | 邻二甲苯只有一种,说明苯分子中不存在单双键交替的碳碳键. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 100mL 18.4mo1•L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA | |
| C. | 标准状况下,2.24 L三氯甲烷中含有碳氯共价键的数目为0.3NA | |
| D. | 用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
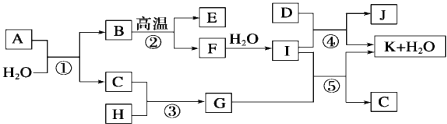
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液与K+、NO3-、OH-可以大量共存 | |
| B. | 该溶液显碱性的原因为ClO-+H2O?HClO+OH- | |
| C. | 向该溶液中滴入少量FeSO4溶液,反应的离子方程式为:2Fe2++ClO-+2H+═Cl-+2Fe3++H2O | |
| D. | 向该溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3 BaSO4↓+2Al(OH)3↓ | |
| B. | 将少量CO2通入NaClO溶液中:ClO-+CO2+H2O═HCO3-+HClO (已知:次氯酸的Ka为2.95×10-8,碳酸的Ka2为5.6×10-11) | |
| C. | 次氯酸钙溶液中通入足量SO2:Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+ | |
| D. | 向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-═CO32-+CaCO3↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com