
(16分)实验室里通常用MnO2与浓盐酸反应制取氯气。现用下列有关装置先制取干燥、纯净的氯气。后进行有关性质实验。试根据下列有关装置回答有关问题。
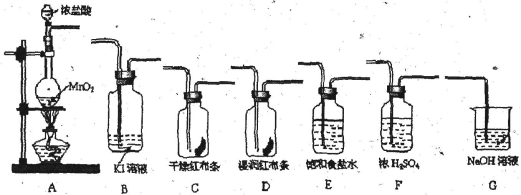
(1)上述装置中各仪器从左至右的连接顺序为A接_ _接_ _接_ _接_ _接_ _接G。
(2)E装置的作用是________ __,D中的现象为___ _ ,B中的现象为_________。
(3)写出相关反应的离子方程式:A中____ ____ ___,G中_____________ _。
(4)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3-物质的量之比为1:1的混合液,反应的化学方程式是______________________________________。
(5) 报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_______________________________________。
(16分) (各2分) (1)E F C D B
(2)除去氯气中的氯化氢气体 湿润的有色布条褪色,无色溶液变黄色(或棕色)溶液
(3) MnO2+4H++2Cl- Mn 2++Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+H2O
Mn 2++Cl2↑+2H2O;Cl2+2OH-=Cl-+ClO-+H2O
(4) 4Cl2+8NaOH═6NaCl+NaClO3+NaClO+4H2O (5) Cl-+ClO-+2H+=Cl2↑+H2O
【解析】
试题分析:(1)实验室用A装置制备氯气,经过除杂E装置、干燥F装置后分别通入C、D装置中进行漂白性性质实验,然后通入到B中验证氯气的强氧化性,氯气有毒,不能直接排放到空气中,应用G装置吸收氯气,则各仪器从左至右的连接顺序为A、E、F、C、D、B、G,故答案为:E;F;C;D;B;
(2)浓盐酸有挥发性,所以氯气中含有氯化氢气体,因饱和食盐水中含有大量的Cl-,对Cl2的溶解有抑制作用,使Cl2+H2O H++Cl-+HClO平衡向左移动,故可用饱和食盐水除去HCl;氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,能使有色布条褪色,所以看到的现象是湿润的红色布条褪色;氯气能和碘化钾发生置换反应生成碘单质,所以看到的现象是溶液由无色变为褐色,故答案为:除去氯化氢;湿润的红色布条褪色;溶液由无色变为褐色;
H++Cl-+HClO平衡向左移动,故可用饱和食盐水除去HCl;氯气和水反应生成盐酸和次氯酸,次氯酸具有漂白性,能使有色布条褪色,所以看到的现象是湿润的红色布条褪色;氯气能和碘化钾发生置换反应生成碘单质,所以看到的现象是溶液由无色变为褐色,故答案为:除去氯化氢;湿润的红色布条褪色;溶液由无色变为褐色;
(3)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl- Mn 2++Cl2↑+2H2O;氯气的氧化性大于碘的氧化性,所以氯气能和碘离子发生置换反应生成碘单质,离子方程式为2I-+Cl2=I2+2Cl-;氯气和氢氧化钠反应生成氯化钠和次氯酸钠、水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
Mn 2++Cl2↑+2H2O;氯气的氧化性大于碘的氧化性,所以氯气能和碘离子发生置换反应生成碘单质,离子方程式为2I-+Cl2=I2+2Cl-;氯气和氢氧化钠反应生成氯化钠和次氯酸钠、水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;
(3)一个氯原子得一个电子生成氯离子,一个氯原子失去1个电子生成次氯酸根离子,一个氯原子失去5个电子生成氯酸根离子,且ClO-与ClO3-物质的量之比为1:1,所以得失电子的最小公倍数为6,该反应的化学反应方程式为4Cl2+8NaOH═6NaCl+NaClO3+NaClO+4H2O;
(5)盐酸有还原性,次氯酸钠在酸性条件下有强氧化性,所以氯离子和次氯酸根离子能发生氧化还原反应生成氯气和水,离子方程式为Cl-+ClO-+2H+=Cl2↑+H2O。
考点:考查氯气的制备、性质实验方案设计与探究以及氧化还原反应的应用


科目:高中化学 来源:2014秋季甘肃省白银市高二第一学期期中理科化学试卷(解析版) 题型:选择题
在密闭容器中进行反应:A(g)+3B(g) 2C(g),有关下列图象说法的不正确的是
2C(g),有关下列图象说法的不正确的是

A.依据图a可判断正反应为放热反应
B.在图b中,虚线可表示使用了催化剂
C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
科目:高中化学 来源:2014秋季甘肃省高二第一学期期中考试文科化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关。下列说法不正确的是
A.铁强化酱油可通过膳食补充人体所需的铁元素
B.地沟油由于混有一些对人体有害的杂质而不能食用,可加工制成生物柴油,生物柴油成分与从石油中提取的柴油成分不同
C.近期媒体报道的某白酒中的增塑剂是对人体健康有害的物质
D.PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
查看答案和解析>>
科目:高中化学 来源:2014秋季湖南省高二上学期第一次阶段测试化学(B)试卷(解析版) 题型:选择题
下列说法中正确的是
A.0.1mol/L HCl和0.1mol/L H2SO4分别与2mol/LNaOH溶液反应速率相同
B.大理石块与大理石粉分别同0.1mol/L盐酸反应速率相同
C.Mg、Al在相同条件下分别与0.1mol/L盐酸反应,其反应速率相同
D.0.1mol/L HCl和0.1mol/LHNO3与相同形状和大小的大理石反应,速率相同
查看答案和解析>>
科目:高中化学 来源:2014秋季湖南省高二上学期第一次阶段测试化学(B)试卷(解析版) 题型:选择题
对于放热反应 ,下列说法正确的是
,下列说法正确的是
A.产物H20所具有的总能量高于反应物H2和O2所具有的总能量
B.反应物H2和O2所具有的总能量高于产物H2O所具有的总能量
C.反应物H2和O2所具有的总能量等于产物H2O所具有的总能量
D.反应物H2和02具有的能量相等
查看答案和解析>>
科目:高中化学 来源:2015届广东省韶关市十校高三10月联考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z原子序数之和为36,X2-与Y+具有相同的核外电子层结构,Y、Z位于同一周期。下列推测不正确的是 ( )
A.同主族元素中X的氢化物稳定性最高
B.同周期元素中Y的金属性最强
C.原子半径Z>Y
D.同周期元素中Z的最高价氧化物的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源:2015届广东省肇庆市高三一模理综化学试卷(解析版) 题型:填空题
(16分)氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变; B.混合气体的颜色不再变化; C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。

试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市毕业班调研测试理综化学试卷(解析版) 题型:选择题
下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面图。下列说法正确的是
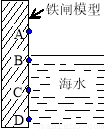
A.该电化腐蚀为析氢腐蚀
B.图中生成铁锈最多的是C区域
C.A区域比B区域更易腐蚀
D.铁闸中的负极的电极反应:Fe-2e- = Fe2+
查看答案和解析>>
科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:计算题
(10分)实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓) 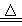 MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
(1)标准状况下生成Cl2的体积为多少? (2)剩余HCl的物质的量为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com