
 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为:分析 (1)已知:①2CO(g)+O2(g)?2CO2(g);△H 2
②2I2(s)+5O2(g)?2I2O5(s);△H 3
根据盖斯定律,①×$\frac{5}{2}$-②×$\frac{1}{2}$可得:5CO(g)+I2O5(s)?5CO2(g)+I2(s);
(2)①a点时二氧化碳体积分数为0.3,反应前后气体物质的量不变,则CO2的物质的量为2mol×0.3=0.6mol,由方程式可知转化的CO为0.6mol,再根据v=$\frac{△c}{△t}$计算v(CO);
化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
②d点时,温度不变,若将容器体积压缩至原来的一半,反应前后气体体积不变,平衡不移动,CO2体积分数不变;
③A.所反应进行容器内气体质量增大,容器内气体密度增大,密度不变表明反应达到平衡状态;
B.两种温度下,c点时体系中二氧化碳的体积分数相等,而两种温度下体系中CO2、CO的物质的量之比相等;
C.I2O5为固体,增大其投料量不影响平衡移动;
D.平衡时b点二氧化碳体积分数大,由平衡常数表达式可知b点平衡常数更大.
解答 解:(1)已知:①2CO(g)+O2(g)?2CO2(g)△H 2
②2I2(s)+5O2(g)?2I2O5(s)△H 3
根据盖斯定律,①×$\frac{5}{2}$-②×$\frac{1}{2}$可得:5CO(g)+I2O5(s)?5CO2(g)+I2(s),则△H 1=2.5△H2-0.5△H3,
故答案为:2.5△H2-0.5△H3;
(2)①a点时二氧化碳体积分数为0.3,反应前后气体物质的量不变,则CO2的物质的量为2mol×0.3=0.6mol,由方程式可知转化的CO为0.6mol,故v(CO)=$\frac{\frac{0.6mol}{2L}}{0.5min}$=0.6mol•L-1•min-1;
b点时化学平衡常数的表达式Kb=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$,
故答案为:0.6mol•L-1•min-1;$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$;
②d点时,温度不变,若将容器体积压缩至原来的一半,反应前后气体体积不变,平衡不移动,CO2体积分数不变,如图所示: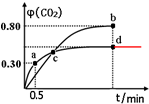 ,
,
故答案为: ;
;
③A.所反应进行容器内气体质量增大,容器内气体密度增大,密度不变表明反应达到平衡状态,故A正确;
B.两种温度下,c点时体系中二氧化碳的体积分数相等,而两种温度下体系中CO2、CO的物质的量之比相等,则平均相对分子质量相等,故B正确;
C.I2O5为固体,增大其投料量不影响平衡移动,CO的转化率不变,故C错误;
D.平衡时b点二氧化碳体积分数大,由平衡常数表达式K=$\frac{{c}^{5}(C{O}_{2})}{{c}^{5}(CO)}$可知b点平衡常数更大,故D错误,
故选:AB.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡常数、反应热计算等,需要学生熟练掌握基础知识并灵活应用.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 水煤气(CO和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1
水煤气(CO和H2)是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:C (s)+H2O(g)?CO (g)+H2 (g)△H=+131.3kJ•mol-1| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | 0.6 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ν正>ν逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某研究小性学习小组的同学欲用如图所示的装置完成下列实验,验证制得的乙烯气体中含有SO2、CO2、水蒸气;确定乙烯与单质溴能否反应及反应类型.
某研究小性学习小组的同学欲用如图所示的装置完成下列实验,验证制得的乙烯气体中含有SO2、CO2、水蒸气;确定乙烯与单质溴能否反应及反应类型.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com