
| A、FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu2+ |
| B、NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| C、将过量的CO2通入Ca(ClO)2溶液中:CO2+H2O+2ClO-+Ca2+=2HClO+CaCO3↓ |
| D、将0.2 mol?L-1的KAl(SO4)2溶液与0.3 mol?L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合物都属于分散系 |
| B、稀豆浆中分散质粒子的直径在1-100nm |
| C、FeCl3溶液中分散质的粒子为FeCl3 |
| D、含有1 mol FeCl3的饱和溶液加入到沸水中生成1 molFe(OH)3胶粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的最简式:C2H4 |
| B、CS2分子的结构式:S═C═S |
| C、醛基的结构简式:-CHO |
D、-OH(羟基)的电子式为: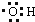 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
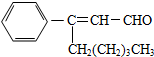 茉莉醛具有浓郁的茉莉花香,其结构简式如图所示,关于茉莉醛的下列叙述正确的是( )
茉莉醛具有浓郁的茉莉花香,其结构简式如图所示,关于茉莉醛的下列叙述正确的是( )| A、茉莉醛与苯甲醛互为同系物 |
| B、在加热和催化剂作用下加氢,每摩尔茉莉醛最多能消耗2mol氢气 |
| C、一定条件下,茉莉醛能被银氨溶液、新制氢氧化铜等多种氧化剂氧化 |
| D、从理论上说,202g茉莉醛能从足量银氨溶液中还原出216g银 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com