
| A.浓硫酸和NaOH溶液反应,生成 l mol水时放热57.3 kJ |
| B.含l molH2SO4的稀硫酸与足量稀NaOH溶液中和后,放热为57.3 kJ |
| C.1L 0.l mol/L CH3COOH与1L 0.l mol/L NaOH溶液反应后放热为5.73 kJ |
| D.1L 0.l mol/L HNO3与 1L 0.l mol/L NaOH溶液反应后放热为 5.73 kJ |
科目:高中化学 来源:不详 题型:单选题
| A.NaOH +HCI |
| B.NaOH( aq)+HC1( aq) |
| C.NaOH(1)+HCl(1) |
| D.NaOH( aq)+HCl( aq) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
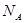 代表阿伏加德罗常数,则关于热化学方程式:C2H2(g) +
代表阿伏加德罗常数,则关于热化学方程式:C2H2(g) + 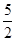 O2(g) ="===" 2 CO2(g) + H2O(l) △H="-1300" kJ/mol的说法中,正确的是( )
O2(g) ="===" 2 CO2(g) + H2O(l) △H="-1300" kJ/mol的说法中,正确的是( )A.当有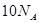 个电子转移时,该反应放出 个电子转移时,该反应放出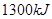 的能量 的能量 |
B.当有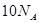 个碳氧共用电子对生成时,放出 个碳氧共用电子对生成时,放出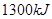 的能量 的能量 |
C.当有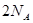 个碳氧共用电子对生成时,放出 个碳氧共用电子对生成时,放出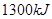 的能量 的能量 |
D.当有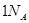 个水分子生成且为液体时,吸收 个水分子生成且为液体时,吸收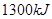 的能量 的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
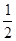 O2(g)=H2O(l) △H3="-285.8KJ/mol "
O2(g)=H2O(l) △H3="-285.8KJ/mol " | A.-488.3 KJ/mol | B.+488.3KJ/mol |
| C.-245.7KJ/mol | D.+245.7KJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2Q1+ Q2 > 4Q3 | B.2Q1+Q2<4Q3 |
| C.Q1 +Q2 <Q3 | D.Q1+Q2=Q3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH (g) △H 1(反应Ⅰ)
CH3OH (g) △H 1(反应Ⅰ)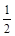 O2(g)=CO2(g) △H 2=-283 kJ·mol-
O2(g)=CO2(g) △H 2=-283 kJ·mol- 1 (反应Ⅱ)
1 (反应Ⅱ)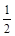 O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)
O2(g)=H2O(g) △H3=-242 kJ·mol-1 (反应Ⅲ)| 化学键 | C-C | C-H | H-H | C-O | C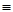 O O | H-O |
| 键能/kJ·mol-1 | 348 | 413 | 436 | 358 | 1072 | 463 |
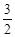 O2(g)=CO2(g)+2H2O(g) △H4
O2(g)=CO2(g)+2H2O(g) △H4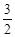 O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下:
O2(g)=CO2(g)+2H2O(l)。其工作原理示意图如下: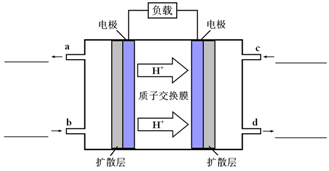
 学式)
学式)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
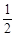 O2(g)
O2(g) | A.– 283.01 kJ · mol – 1 | B.+ 172.51 kJ · mol – 1 |
| C.+ 283.01 kJ · mol – 1 | D.+ 504.00 kJ · mol – 1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.+ 488.3 kJ/mol | B.-488.3 kJ/mol |
| C.-244.15 kJ/mol | D.+ 244.15 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com