
分析 常温下将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L溶液,氯化铵和氢氧化钠反应生成一水合氨和氯化钠,反应的定量关系可知氯化铵过量,溶液中为NH3•H2O、NaCl、NH4Cl溶质.
(1)氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,溶液中存在铵根离子水解平衡,一水合氨形成的化学平衡,水的电离平衡;
(2)反应后溶质为一水合氨、氯化钠和氯化铵,依据电解质电离方式判断离子类别;
(3)找出溶液中阳离子,阴离子,依据溶液呈电中性,则阳离子带正电荷总数等于阴离子带负电荷总数.
解答 解:(1)氯化铵和氢氧化钠反应生成一水合氨和氯化钠,氯化铵过量,溶液中存在铵根离子水解平衡,NH4++H2O?NH3•H2O+H+,一水合氨是弱电解质存在电离平衡,NH3•H2O?NH4++OH-,溶液中溶剂水也是弱电解质存在电离平衡,H2O?OH-+H+,该溶液中除H2O的电离平衡外还存在的平衡体系是水解平衡,NH4++H2O?NH3•H2O+H+,一水合氨的电离平衡,NH3•H2O?NH4++OH-,
故答案为:H2O?H++OH-,NH3•H2O?NH4++OH-,NH4++H2O?NH3•H2O+H+;
(2)溶液中为NH3•H2O、NaCl、NH4Cl溶质和溶剂水,一水合氨部分电离生成铵根离子和氢氧根离子,氯化钠完全电离生成钠离子、氯离子,氯化铵完全电离生成铵根离子和氯离子,水分子部分电离生成氢离子和氢氧根离子,所以溶液中存在的微粒为NH4+、OH-、H+、Na+、Cl-、NH3•H2O、H2O,共7种微粒;
故答案为:H2O,NH3•H2O,NH4+,OH-,H+,Cl-,Na+;
(3)反应后溶液中阳离子为:H+、Na+、NH4+,阴离子为:OH-、Cl-,溶液呈电中性则阳离子带正电荷总数等于阴离子带负电荷总数,即:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(Cl-);
故答案为:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(Cl-);
点评 本题考查了电解质的电离,盐类水解原理,明确电解质电离方式,熟悉溶液中存在的电荷守恒规律是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:2:1 | D. | 1:4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 | |
| B. | 苯不能使酸性高锰酸钾褪色,说明苯环中没有碳碳双键 | |
| C. | 甲烷中混有的乙烯可以用溴的四氯化碳溶液除去 | |
| D. | 医院用75%酒精杀菌、消毒,75%是指质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
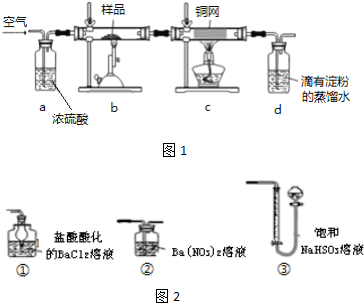
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉碘化钾溶液加酸后变蓝:4I-+O2+4H+═2I2+2H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| C. | 在Fe(NO3)2和KI组成的混合溶液中滴入少量稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+NH3•H2O+Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物  的消去(分子内脱水)产物只有2种 的消去(分子内脱水)产物只有2种 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2═CH-COOCH3 | |
| D. | 可用溴水鉴别已烯、四氯化碳和乙酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
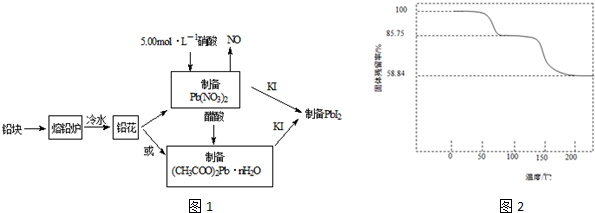
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com