
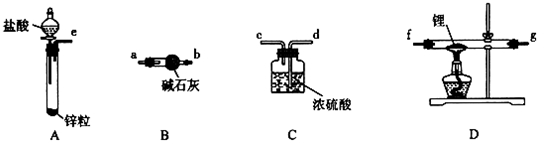
分析 (1)氢气和锂发生反应生成LiH,制备LiH固体需要制备氢气,LiH在干燥的空气中能稳定存在,遇水或酸能够引起燃烧,所以制备得到的氢气必须干燥纯净,利用A装置制备氢气,用装置B中的碱石灰除去氢气中的氯化氢和水蒸气,通入装置D中加热和锂反应生成氢化锂,最后连接装置C,防止空气中的水蒸气和二氧化碳进入装置D和生成的氢化锂发生反应;
制备气体装置,加入药品前首先要进行的实验操作是:检验装置气密性;
(2)石蜡是有机物,易溶解于有机溶剂甲苯;
(3)使用前应通入一段时间氢气,排尽装置内的空气,防止加热时氢气不纯发生爆炸危险;
(4)LiH与H2O发生水解反应,锂离子结合氢氧根离子,氢负离子与氢离子结构生成氢气,LiH与乙醇反应类似,羟基提供H原子与LiH反应生成氢气,另外部分结合生成CH3CH2OLi;
(5)设LiH与Li的物质的量分别为xmol、ymol,根据方程式表示出生成氢气的物质的量,再根据二者总质量、氢气总体积列方程计算解答;
解答 解:(1)氢气和锂发生反应生成LiH,制备LiH固体需要制备氢气,LiH在干燥的空气中能稳定存在,遇水或酸能够引起燃烧,所以制备得到的氢气必须干燥纯净,利用A装置制备氢气,用装置B中的碱石灰除去氢气中的氯化氢和水蒸气,通入装置D中加热和锂反应生成氢化锂,最后连接装置C,防止空气中的水蒸气和二氧化碳进入装置D和生成的氢化锂发生反应,装置连接顺序为:e接a,b接f,g接d;
制备气体装置,加入药品前首先要进行的实验操作是:检验装置气密性;
装置B中碱石灰是氧化钙和氢氧化钠的混合物,氧化钙与水可反应,氢氧化钠可作干燥剂,且与盐酸能反应,所以该装置的作用是吸收水蒸气和部分氯化氢气体,
故答案为:a,b接,d;检验装置气密性;除去H2中的H2O和HCl;
(2)取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,利用石蜡是有机物易溶解于有机溶剂甲苯中,操作的目的是除去锂表面的石蜡,
故答案为:除去锂表面的石蜡;
(3)使用前应通入一段时间氢气,排尽装置内的空气,防止加热时氢气不纯发生爆炸危险,在加热D处的石英管之前,必须进行的实验操作是:收集c处排出的气体并检验H2纯度,
故答案为:收集c处排出的气体并检验H2纯度;
(4)LiH与H2O发生水解反应,锂离子结合氢氧根离子,氢负离子与氢离子结构生成氢气,LiH与乙醇反应类似,羟基提供H原子与LiH反应生成氢气,另外部分结合生成CH3CH2OLi,反应方程式为:LiH+CH3CH2OH=CH3CH2OLi+H2↑,
故答案为:LiH+CH3CH2OH=CH3CH2OLi+H2↑;
(5)设LiH与Li的物质的量分别为xmol、ymol,则:
LiH+H2O=H2↑+LiOH
xmol xmol
2Li+2H2O=2LiOH+H2↑
ymol 0.5y mol
则$\left\{\begin{array}{l}{8x+7y=0.174}\\{22.4(x+0.5y)=0.4704}\end{array}\right.$,
解得x=0.02、y=0.002
故LiH与Li的物质的量之比为0.02mol:0.002mol=10:1,
故答案为:10:1.
点评 本题考查化学实验制备方案,理解原理是解题关键,涉及对装置及操作的分析评价、气体收集、化学方程式的计算等,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 给试管中的液体加热时,试管口不准对着别人,但可以对着自己 | |
| B. | 玻璃仪器都可以用于加热 | |
| C. | 在H2还原氧化铜的实验中,应把H2通过预先加热的氧化铜 | |
| D. | 无论给试管中的液体还是固体加热,都必须先预热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 集气瓶中所含物质可能是纯净物 | |
| B. | 集气瓶中可能只含有两种单质 | |
| C. | 集气瓶中不可能既存在单质又存在化合物 | |
| D. | 集气瓶中可能含有一种单质和一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锗的第一电离能高于碳而电负性低于碳 | |
| B. | 乙烯分子中,只有一个碳碳π键,四个碳氢σ键 | |
| C. | 在铁制品上镀铜时,镀件为阳极,铜盐溶液为电镀液 | |
| D. | 甲醇分子内的O-C-H键角小于甲醛分子内O-C-H键角 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
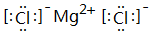 ,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.
,此化合物是(是、否)属于电解质,其溶于水所克服的微粒间作用力为离子键.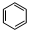 +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$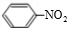 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 银氨溶液:Na+、K+、NO3-、NH3•H2O | |
| B. | 存在Fe2+的溶液中:Mg2+、SO42-、ClO-、Na+ | |
| C. | 氢氧化铁胶体:H+、K+、S2-、Br- | |
| D. | 高锰酸钾溶液:H+、Na+、SO42-、葡萄糖分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com