
【题目】某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是( )
A. 容量瓶用蒸馏水洗涤干净后没有干燥 B. 定容时仰视
C. 砝码上沾有杂质 D. 没冷却至室温就定容
科目:高中化学 来源: 题型:
【题目】新型无机非金属材料氮化硼(BN)可用于火箭的燃料喷嘴。已知BN可以在高温下通过:B2O3(s)+2NH3(g) ![]() 2BN(s)+3H2O(g)反应制得,实际中还添加Ca3(PO4)2作为填料,以降低B2O3熔体的黏度。下列有关说法正确的是( )
2BN(s)+3H2O(g)反应制得,实际中还添加Ca3(PO4)2作为填料,以降低B2O3熔体的黏度。下列有关说法正确的是( )
A. 反应中B2O3是氧化剂 B. 若消耗2.24LNH3理论上可得2.5gBN
C. 填料的作用可使反应物充分接触 D. 反应时NH3需要用无水CaCl2干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是一种重要的高分子化合物,其合成路线如下:
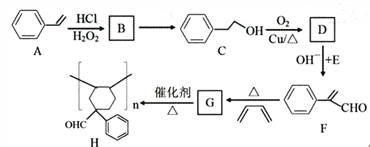
已知: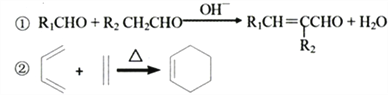
请回答下列问题:
(1)A的名称是_______________,C中含氧官能团名称是______________。
(2)写出反应类型:A→B______________,C→D__________________。
(3)B→C的反应试剂和反应条件是______________________。
(4)D+E→F的反应方程式是_________________。
(5)G的分子式是____________________。
(6)满足下列条件的F的同分异构体共有__________种(不考虑立体异构)。
a.苯环上有两个取代基,无其他环状结构;b.含碳碳三键,无-C≡COH结构。
(7)多环化合物是有机研究的重要方向,请设计由![]() 、.CH3CHO、
、.CH3CHO、![]() -CHO合成多环化合物
-CHO合成多环化合物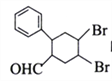 的路线(无机试剂任选)______________
的路线(无机试剂任选)______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】学生研究性学习小组设计实验,用于制取SO2并探究SO2的某些性质。制取SO2反应的化学方程式为:Na2SO3+2H2SO4→Na2SO4+SO2↑+H2O,产生的气体通入如图所示装置:
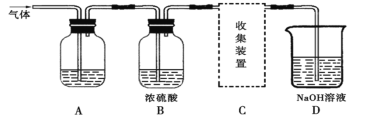
(实验探究)
(1)将12.6g的Na2SO3与足量的浓硫酸反应可制得SO2的体积为___________L(标准状况),该制取SO2的反应________(选填“是”或“不是”)氧化还原反应。
(2)若用A装置检验SO2具有漂白性,则A中的溶液是_________。
若用A装置检验SO2是一种酸性氧化物,则A中的溶液是_________。
(3)D装置中发生的反应是(写化学方程式):____________________________________。
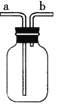
(实验讨论)
(4)对如图中的C处,甲、乙两同学都选用如图装置,但对连接方式持有不同意见。甲同学认为:SO2气体应从a处通入集气瓶中。乙同学认为:SO2气体应从b处通入集气瓶中。你认为________(填“甲”或“乙”)同学的看法是正确的。
(联系实际)
(5)SO2对环境的影响较大,为了减少SO2对空气的污染,请你从工业生产的角度提出一种有效可行的措施(用文字表述):________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是合成农药的重要中间体,其合成路线如下:
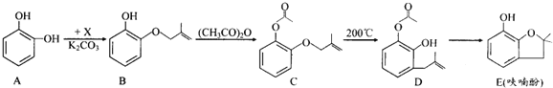
(1)A在空气中久置会由无色转变为棕褐色,其原因是____________,A在核磁共振氢谱中有___________组峰。
(2)B→C的反应类型是_____________________。
(3)已知X的分子式为C4H7Cl。写出A→B的化学方程式:___________________。
(4)要鉴别化合物C和D,适宜的试剂是__________________________。
(5)B的同分异构体很多,符合下列条件的有______种,写出其中能发生银镜反应的同分异构体的结构简式:__________(任写一种)。
①苯的衍生物 ②有两个互为对位的取代基 ③含有酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图,下列叙述正确的是( )
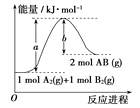
A. 每生成2分子AB吸收b kJ热量
B. 该反应中反应物的总能量高于生成物的总能量
C. 该反应热ΔH=+(a-b) kJ·mol-1
D. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
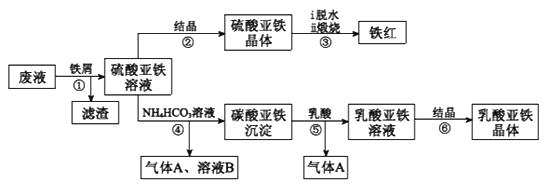
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiOSO4水解成TiO2xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作是________________________。
(2)加入铁屑的目的一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2xH2O滤渣,用平衡移动的原理解释得到滤渣的原因___________________________。
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为____________________________。
(4)用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因_________________。
(5)步骤④的离子方程式是_________________________________________。
(6)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及___________________。
(7)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 molL-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为______(用a表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)在有机合成、化工生产方面有广泛应用。制备硼氢化钠的化学方程式为NaBO2+2SiO2+4Na+2H2![]() NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
NaBH4+2Na2SiO3。下列有关上述反应的说法错误的是( )
A. 氧化产物和还原产物的物质的量之比为2:1
B. 转移4 mol电子时,只需向装置中通入44.8 L H2(标准状况)
C. 装药品之前加热装置至100℃并持续一会儿
D. 制备硼氢化钠的副产物可能有NaH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017 年世界地球日我国的主题为“节约集约利用资源,倡导绿色简约生活”。下列做法和导向不应提倡的是
A. 塞罕坝人在沙漠植树造林 B. 绿水青山就是金山银山
C. 对商品豪华包装促进销售 D. 我市的蓝天白云工程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com