

分析 (1)乙烯、氯乙烯中均含碳碳双键,为平面结构,而聚氯乙烯中不含不饱和键;
(2)根据1,2-二氯乙烷热分解生成氯乙烯和A判断出的化学式;
(3)从该反应过程中不向环境排放有害物质分析;
(4)反应③为乙烯、氧气、氯气反应生成氯乙烯.
解答 解:(1)乙烯、氯乙烯中均含碳碳双键,为平面结构,而聚氯乙烯中不含不饱和键,则
A.含烃及烃的衍生物,都能在氧气中燃烧,故A正确;
B.乙烯、氯乙烯都能发生加成反应,使溴水褪色,而聚氯乙烯不能,故B错误;
C.乙烯、氯乙烯都能使得酸性高锰酸钾褪色,而聚氯乙烯不能,故C错误;
D.氯乙烯为平面结构,则分子中所有原子共平面,故D正确;
故答案为:AD;
(2)根据质量守恒定律可知: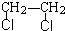 热裂解生成氯乙烯和氯化氢,所以A为HCl,故答案为:HCl;
热裂解生成氯乙烯和氯化氢,所以A为HCl,故答案为:HCl;
(3)由合成路线可知,二氯乙烷热裂解生成HCl,再用于合成氯乙烷,从而使氯得到利用,不向环境排放有害气体,
故答案为:使氯得到利用,不向环境排放有害气体;
(4)反应③为乙烯、氧气、氯气反应生成氯乙烯,该反应为4CH2=CH2+2Cl2+O2→4CH2=CHCl+2H2O,
故答案为:4CH2=CH2+2Cl2+O2→4CH2=CHCl+2H2O.
点评 本题考查有机物的合成,为高考常见题型,侧重合成反应及环境保护的考查,把握官能团及性质的关系、酯化反应、燃烧反应即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 溶液中c(Na+)═10-3mol/L | B. | 溶液中 c(R2-)>c(Na+)>c(H+)>c(OH-) | ||
| C. | 溶液中 c(R2-)+c(OH-)+c(HR-)═c(Na+)+c(H+) | D. | 溶液中 2c(R2-)+c(HR-)═c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的体积:10V甲≤V乙 | |
| B. | 水电离出的OH-浓度:10c(OH-)=═c(OH-)乙 | |
| C. | 若分别与5mLpH=11的NaOH溶液反应,所得溶液可能显酸性 | |
| D. | 若分别用等浓度的NaOH溶液完全中和,消耗NaOH溶液的体积不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化工原料,又可作为燃料.
甲醇是重要的化工原料,又可作为燃料.| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+ | B. | Cr2O${\;}_{7}^{2-}$ | C. | Br2 | D. | HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图装置中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5mol/L的CuSO4溶液.向甲烧杯中滴入几滴酚酞,反应一段时间后,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为变小(选填“变大”、“变小”、“不变”).通电一段时间后(溶液中还有CuSO4),停止通电.若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入AC (填序号).
如图装置中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5mol/L的CuSO4溶液.向甲烧杯中滴入几滴酚酞,反应一段时间后,观察到石墨电极附近首先变红,乙烧杯中石墨电极附近pH值的变化为变小(选填“变大”、“变小”、“不变”).通电一段时间后(溶液中还有CuSO4),停止通电.若要使乙烧杯中电解质溶液恢复到电解前的状态,可加入AC (填序号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com