

分析 有单质生成的分解反应属于氧化还原反应,没有元素化合价变化的分解反应不属于氧化还原反应,反应类型Ⅲ为非氧化还原反应,如酸碱中和反应;反应类型Ⅳ为氧化还原反应,以此来解答.
解答 解:由图可知,I、Ⅱ部分为氧化还原反应,有单质生成的分解反应属于氧化还原反应,没有元素化合价变化的分解反应不属于氧化还原反应,则Ⅱ为分解反应;反应类型Ⅲ为非氧化还原反应,如NaOH+HCl═NaCl+H2O;反应类型Ⅳ为氧化还原反应,如H2+CuO $\frac{\underline{\;高温\;}}{\;}$Cu+H2O,
故答案为:分解;NaOH+HCl═NaCl+H2O;H2+CuO $\frac{\underline{\;高温\;}}{\;}$Cu+H2O.
点评 本题考查氧化还原反应,为高频考点,把握四种基本反应类型与氧化还原反应的关系为解答的关键,侧重分析与应用能力的考查,注意答案不唯一,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
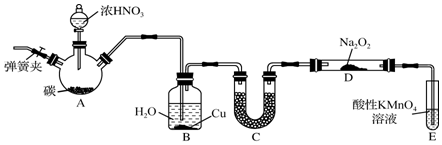
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
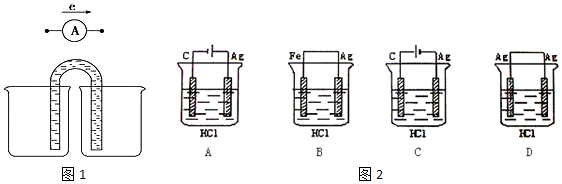
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四个共价单键 | B. | 一个双键,一个三键 | ||
| C. | 两个单键,一个双键 | D. | 一个单键,一个三键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
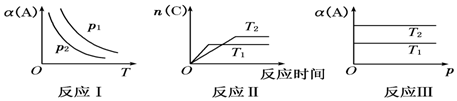
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:填空题
(1)在25℃、101kPa下, 1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧热的热化学方程式: 。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1 = —702 kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2 = —182 kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s) △H3=  。
。
(3)已知 2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的 ΔH=—99kJ·mol-1.请回答下列问题:

①图中A、C分别表示 、 ,
②E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是
③图中△H= kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com