
| A. | 将10 mL该溶液稀释至100 mL后,pH=4 | |
| B. | 向该溶液中加入等体积pH为12的氨水恰好完全中和 | |
| C. | 该溶液中盐酸电离出的c(H+)与水电离出的c(H+)之比为1010:1 | |
| D. | 该溶液中由水电离出的c(H+)水×c(OH-)水=1×10-14 |
分析 A、盐酸溶液中氯化氢完全电离,溶液稀释10倍,溶液pH增大一个单位;
B、一水合氨是弱电解质存在电离平衡;
C、常温下pH为2的盐酸溶液中,水电离出的氢氧根离子浓度和氢离子浓度相同为10-12mol/L;
D、常温下pH为2的盐酸溶液中酸中氢离子浓度为10-2mol/L,水电离出的氢离子浓度为10-12mol/L.
解答 解:A、盐酸溶液中氯化氢完全电离,溶液稀释10倍,溶液pH增大一个单位,将10mL该溶液稀释至100mL后,pH等于3,故A错误;
B、一水合氨是弱电解质存在电离平衡,向该溶液中加入等体积pH为12的氨水,平衡状态下的氢氧根离子恰好完全中和,一水合氨又电离出氢氧根离子,一水合氨过量,故B错误;
C、pH为2的盐酸溶液中酸中氢离子浓度为10-2mol/L,水电离出的氢离子浓度为10-12mol/L,溶液中盐酸电离的c(H+)与水电离出的c(H+)之比为1010:1,故C正确;
D、常温下pH为2的盐酸溶液中,水电离出的氢氧根离子浓度和氢离子浓度相同为10-12mol/L,由水电离出的c(H+),c(水)×c(OH-)(水)=1×10-24,故D错误;
故选C.
点评 本题考查了水的电离分析,弱电解质电离平衡的理解应用,掌握溶液中离子积常数的计算方法和含义是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题

| A. | 分子式是C20H12O4 | B. | 能与NaOH稀溶液反应,溶液显红色 | ||
| C. | 能与溴水反应,溶液显红色 | D. | 与羧酸发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当pH=7时,若V1=V2,则一定是c2>c1 | |
| B. | 在任何情况下都满足c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 若pH>7,则一定是c1V1>c2V2 | |
| D. | 若V1=V2,c1=c2,则c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
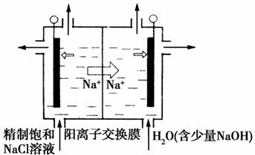 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
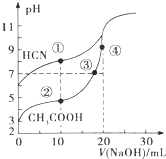
| A. | 点③溶液中,c(OH-)=c(H+)+c(CH3COOH) | |
| B. | 点①溶液的c(CN-)<点②溶液的c(CH3COO-) | |
| C. | 点④溶液中,c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 在点②和③之间(不包括端点)存在离子浓度大小关系:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
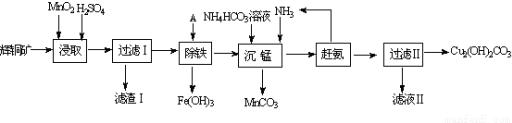
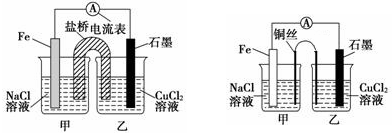
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 1mol/L的稀硝酸中,氧原子数为3NA | |
| B. | 常温常压下的67.2L氯气与54g铝充分反应,转移电子数为6NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电数为0.2NA | |
| D. | 标准状况下,80gSO3,中含3NA心个氧原子,体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com