
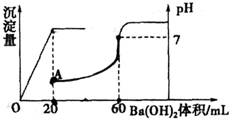
 有硫酸和盐酸的混合液共20mL,在此溶液中滴入0.025mol?L-1的Ba(OH)2溶液,生成BaSO4的量和溶液pH的变化如图,求:
有硫酸和盐酸的混合液共20mL,在此溶液中滴入0.025mol?L-1的Ba(OH)2溶液,生成BaSO4的量和溶液pH的变化如图,求:| 1 |
| 1 |
| x |
| 0.02L×0.025mol/L |
| 0.0005mol |
| 0.02L |
| 1 |
| 1 |
| y |
| 0.04L×2×0.025mol/L |
| 0.002mol |
| 0.02L |
| 0.1mol/L×0.02L |
| 0.02L+0.02L |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:山东省莘县实验高中2010届高三上学期模拟考试化学试题 题型:038
有硫酸和盐酸的混合液共20 mL,在此溶液中滴入0.025 mol·L-1的Ba(OH)2溶液,生成BaSO4的量和溶液pH的变化如图,求:

(1)滴入Ba(OH)2前原混合液中盐酸和硫酸的物质的量浓度:________
mol/L和________mol/L.(2)A点溶液的pH=________.(lg5=0.7)
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)滴入Ba(OH)2前盐酸和硫酸的物质的量浓度。?
(2)A、B两点溶液的pH。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:2009-2010学年山东省聊城三中高三(上)月考化学试卷(12月份)(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com