
在673K,1.01×105帕下,有1mol某气体A,发生如下反
![]()
中的体积百分含量为58.6%,混合气的总质量为46g,密度为0.72g·L-1。求:
(1)达到平衡后混合气的平均分子量
(2)A的转化率
(3)B的系数x的值
(4)相同条件下反应前A气体的密度是平衡混合气密度的多少倍?
【答案】 (1)39.8;(2)32%;(3)2;(4)1.16
【解析】本题的错误主要产生于对密度的认识。由于达到平衡时,该体系处于非标准状况下,题目给的密度也是非标准状况下的密度,因此不能简单以该密度和气体的摩尔体积乘积来计算混合气体的平均摩尔质量。
(1)通过以下换算,先计算非标准状况下气体的摩尔体积,进而再计算混合气体的平均摩尔质量:
![]()
![]()
所以混合气体平均分子量为:39.8

(3)B的系数x=2
(4)在相同状况下,密度比等于其摩尔质量比。所以密度比为:1.16
【状元纠错】 (1)达到平衡后混合气的平均摩尔质量为:
0.72g·L-1×22.4L·mol-1=16.128g·mol-1;
平均分子量为:16.1,混合气体的物质的量为2.86mol,由此产生一系列的错误结果。


科目:高中化学 来源: 题型:阅读理解
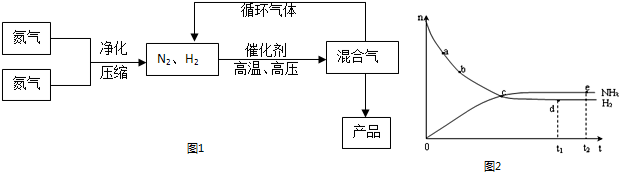
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:038
在673K,1.01![]() 帕下,有1摩某气体A,发生如下反应:2A(气)
帕下,有1摩某气体A,发生如下反应:2A(气)![]()
![]() B(气)+ C(气)并达到平衡,A在平衡混合气中的体积百分含量为58.6%,混合气的总质量为46 g,密度为0.72 g
B(气)+ C(气)并达到平衡,A在平衡混合气中的体积百分含量为58.6%,混合气的总质量为46 g,密度为0.72 g![]() 。求:
。求:
(1)达到平衡后混合气的平均分子量
(2)A的转化率
(3)B的系数![]() 的值
的值
(4)相同条件下反应前A气体的密度是平衡混合气密度的多少倍?
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
(1)达到平衡后混合气的平均分子量
(2)A的转化率
(3)B的系数![]() 的值
的值
(4)相同条件下反应前A气体的密度是平衡混合气密度的多少倍?
查看答案和解析>>
科目:高中化学 来源:同步题 题型:计算题
 xB(气)+C(气)。在一定条件下已达到平衡。在平衡混合气体中,A占其体积百分比为58.84%。混合气体总质量为46g,密度为0.72g·L-1。求
xB(气)+C(气)。在一定条件下已达到平衡。在平衡混合气体中,A占其体积百分比为58.84%。混合气体总质量为46g,密度为0.72g·L-1。求查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com