
| A. | H2O2的氧化性比Fe3+强,其还原性比Fe2+弱 | |
| B. | 在H2O2分解过程中,溶液的酸性增强 | |
| C. | H2O2分解的总方程式为:H2O2═H2O+O2↑ | |
| D. | H2O2生产过程要严格避免混入Fe2+ |
分析 反应2Fe2++H2O2+2H+═2Fe3++2H2O中,Fe2+被H2O2氧化生成Fe3+,
反应2Fe3++H2O2═2Fe2++O2↑+2H+中,Fe3+被H2O2还原生成Fe2+,Fe2+可为H2O2分解的催化剂,结合具体的化学反应来解答.
解答 解:A、由2Fe2++H2O2+2H+=2Fe3++2H2O、2Fe3++H2O2=2Fe2++O2↑+2H+可知,H2O2的氧化性>Fe3+的氧化性,H2O2的还原性>Fe2+的还原性,故A错误;
B、将两个反应相加可得2H2O2=2H2O+O2↑,所以分解过程中,Fe2+作催化剂,溶液pH值不变,故B错误;
C、将两个反应相加可得2H2O2=2H2O+O2↑,所以总方程式为:2H2O2═2H2O+O2↑,故C错误;
D、Fe2+为H2O2分解的催化剂,可导致H2O2分解,所以H2O2生产过程要严格避免混入Fe2+,故D正确;
故选D.
点评 本题考查氧化还原反应,明确反应中氧化性的比较规律及两个化学反应的关系及催化剂在反应在的作用即可解答,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等 | |
| B. | 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) | |
| C. | 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2:三种溶液中NH4+的浓度:②>③>① | |
| D. | 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N前>N后 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ;此固体所含化学键类型为离子键、共价键;此固体与AB2反应的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2.
;此固体所含化学键类型为离子键、共价键;此固体与AB2反应的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将水加入浓硫酸中得到稀硫酸,置镁条于其中探究Mg的活泼性 | |
| B. | 将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 | |
| C. | 将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 | |
| D. | 将Mg(OH)2沉淀转入蒸发皿中,加热可得MgO固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
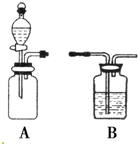 如图是中学化学中常见的实验装置.
如图是中学化学中常见的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是国际单位制的7个基本物理量之一 | |
| B. | 物质的量可以理解为物质的质量 | |
| C. | 物质的量的单位是“摩尔” | |
| D. | 物质的量是表示物质的数量的单位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 析出的氢氧化钠的质量为大于$\frac{40a}{31}$g | |
| B. | 单位体积溶液中OH-个数不变 | |
| C. | 溶液中Na+数目减少 | |
| D. | 氧化钠与水反应生成了碱,所以溶质的质量分数变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
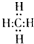 ,结构式是
,结构式是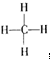 ,能说明它是正四面体而非正方形平面结构的理由是②.(填写编号)
,能说明它是正四面体而非正方形平面结构的理由是②.(填写编号)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com