
| A. | 在一定条件下,苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应 | |
| B. | 戊烷有4种同分异构体,它们熔点、沸点各不相同 | |
| C. | 油脂发生皂化反应可以得到高级脂肪酸盐与甘油 | |
| D. | 淀粉和蛋白质都属于高分子化合物 |
分析 A.苯中H被Br、硝基取代;
B.有CH3CH2CH2CH2CH3、 、
、 ,共3种,支链越多,沸点越低;
,共3种,支链越多,沸点越低;
C.油脂在碱性条件水解为皂化反应;
D.淀粉和蛋白质的相对分子质量均为10000以上.
解答 解:A.苯中H被Br、硝基取代,则苯与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应,故A正确;
B.有CH3CH2CH2CH2CH3、 、
、 ,共3种,支链越多,沸点越低,则戊烷有3种同分异构体,它们熔点、沸点各不相同,故B错误;
,共3种,支链越多,沸点越低,则戊烷有3种同分异构体,它们熔点、沸点各不相同,故B错误;
C.油脂在碱性条件水解为皂化反应,则得到高级脂肪酸盐与甘油,故C正确;
D.淀粉和蛋白质的相对分子质量均为10000以上,则均为高分子,故D正确;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机反应、同分异构体、高分子判断为解答的关键,侧重分析与应用能力的考查,注意同分异构体的性质,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、SO42-、HCO3- | B. | K+、Na+、Cl-、SO42- | ||
| C. | K+、Cu2+、NO3-、SO42- | D. | K+、Fe2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Fe+2O2$\frac{\underline{\;点燃\;}}{\;}$Fe3O4 | B. | CO2+C$\frac{\underline{\;\;△\;\;}}{\;}$2CO | ||
| C. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O↑+CO2↑ | D. | CaCO3+CO2+H2O═Ca(HCO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 2:1:1 | C. | 3:1:1 | D. | 1:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
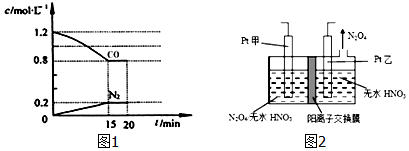
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 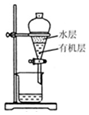 用如图装置分离有机 层与水层,水层从分液 漏斗下口放出 | |
| B. | 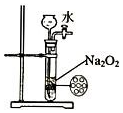 用如图装置可用来制 备少量氧气,并且控制 反应的发生与停止 | |
| C. | 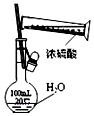 如图中配制一定物质的量浓度的硫酸溶液不能 直接在容量瓶中进行 | |
| D. | 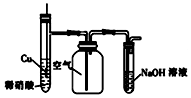 用如图装置制备并收集NO气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
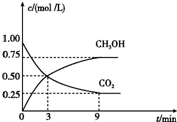 中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com