
| A. | 1mol NH5中含有5NA个N-H键 | |
| B. | NH5中N元素的化合价为-5价 | |
| C. | 与水反应时,原理和NaH与水反应相同 | |
| D. | 与乙醇反应时,NH5被还原 |
分析 A.NH5是离子化合物氢化铵,由氢离子和铵根离子构成,根据构成离子计算含有氮氢键个数;
B.根据元素化合价的代数和为0计算氮元素的化合价,注意NH5属于离子晶体;
C.NH4H中氢离子为-1价;
D.得电子化合价降低的反应物是氧化剂,氧化剂在反应中被还原.
解答 解:A.NH5是离子化合物氢化铵,所以1molNH5中有4NA个N-H键,故A错误;
B.NH5属于离子化合物,其化学式为NH4H,氢离子为-1价,铵根离子中氢元素为+1价,则氮元素为-3价,故B错误;
C.NH4H中氢离子为-1价,NaH中H为-1价,所以与水反应时,原理和NaH与水反应相同,故C正确;
D.根据NH5与水反应类比知,与乙醇反应时,NH5中氢离子的化合价由-1价→0价,所以失电子作还原剂,NH5在氧化还原反应中被氧化,故D错误;
故选C.
点评 本题考查了氧化还原反应,难度较大,能根据题意判断化合物NH5含有的离子是解本题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:解答题
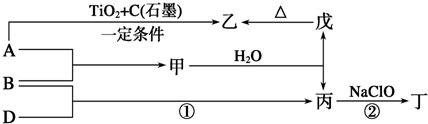
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. | 对二甲苯 | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某盐溶液中加入NaOH溶液有白色沉淀出现,则原溶液中一定含有Mg2+ | |
| B. | 某溶液中加入AgNO3溶液有白色沉淀出现,则原溶液中一定含有Cl- | |
| C. | 某溶液中加入盐酸产生能使澄清石灰水变浑浊的无色无味的气体,则原溶液中一定含有${CO}_{3}^{2-}$和${HCO}_{3}^{-}$中的一种 | |
| D. | 某盐溶液中加入NaOH溶液并加热,能产生使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定含有${NH}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | ②⑥ | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液溴易挥发,应用少量的水液封并放在冷暗处保存 | |
| B. | 硝酸见光易分解、易挥发,应用棕色广口试剂瓶密封保存 | |
| C. | 金属钠遇到氧气和水均立即反应,应保存在煤油中或者液体石蜡里 | |
| D. | 碳酸钠虽然属于盐,但是其水溶液呈碱性,应用带橡胶塞的试剂瓶保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFe与1molCl2充分反应,转移的电子数为3NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+数为2NA | |
| C. | 60克SiO2中含有1mol SiO2分子 | |
| D. | 1L1mol•L-1的NaClO溶液中含有ClO-的数目小于1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质熔、沸点逐渐降低 | B. | 单质的氧化性逐渐增强 | ||
| C. | 气态氢化物沸点逐渐升高 | D. | 气态氢化物稳定性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
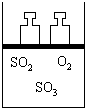 如图所示,将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,试回答:
如图所示,将4mol SO2和2mol O2混合置于体积可变的等压容器中,在一定温度下发生如下反应:2SO2(g)+O2(g)?2SO3(g);△H<0.该反应达到平衡状态A时,测得气体总物质的量为4.2mol.若SO2、O2、SO3的起始物质的量分别用a、b、c 表示,试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com