
| A. | 元素Y、Z、W具有相同电子层结构的离子,其半径依次增大 | |
| B. | 39g化合物Z2Y2与X2Y反应转移电子数约为6.02×1023 | |
| C. | 元素Y、R分别与元素X形成的倾听合物的热稳定性:XmY>XmR | |
| D. | 元素Z、R的氧化物的水化物相互反应生成的盐呈中性或碱性 |
分析 X、Y、Z、W、R是5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,应为H元素,Y原子最外层电子数是次外层电子数的3倍,应为O元素;根据Z、W、R处于同一周期,R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,又Z、W、处于同一周期,应为第三周期,故Z为Na,W为Al元素.结合物质性质与元素周期律解答.
解答 解:X、Y、Z、W、R是5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,应为H元素,Y原子最外层电子数是次外层电子数的3倍,应为O元素;根据Z、W、R处于同一周期,R与Y处于同一族,则R为S元素;Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等,则Z、W原子的核外电子数之和为8+16=24,又Z、W、处于同一周期,应为第三周期,分别为Na和Al元素,
A.Y是O元素,Z是Na元素,W是Al元素,Y、Z、W具有相同电子层结构的离子(O2-、Na+、Al3+),根据核外电子排布相同的微粒,半径随着核电荷数的增加而减小,所以离子半径O2->Na+>Al3+,故A错误;
B.Na2O2由钠离子与过氧根离子构成,39gNa2O2中含有的离子数约为$\frac{39g}{78g/mol}$×3×6.02×1023mol-1=9.03×1023,故B错误;
C.元素Y、R分别与元素X形成的化合物是氢化物,因为Y(O元素)和R(S元素)的非金属性强弱:Y>R,所以对应的氢化物的稳定性:XmY>XmR,故C正确;
D.元素Z、R的氧化物的水化物分别为NaOH、H2SO4,相互反应生成的盐呈中性,故D错误;
故选C.
点评 本题考查结构位置性质关系应用,涉及元素周期律、微粒半径比较等,题目难度中等,推断元素是关键,注意掌握半径比较规律.


科目:高中化学 来源: 题型:选择题
| A. | 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 | |
| B. | 2.0 mol SO2+1.0 mol O2+2.0 mol SO3 | |
| C. | 3.0 mol SO2+0.5 mol O2+1.0 mol SO3 | |
| D. | 3.0 mol SO2+1.0 mol O2+1.0 mol SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维中所用材料为晶体硅 | B. | 水玻璃可用作木材防火剂 | ||
| C. | 氯气可用于自来水的杀菌消毒 | D. | Fe2O3可以做油漆的颜料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=2.25 y=4.74% | B. | x=5 y=11.11% | ||
| C. | x=5 y=10% | D. | x=2.875 y=5.75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
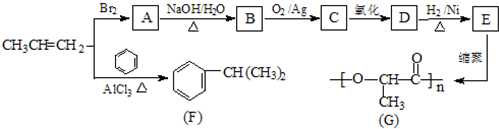
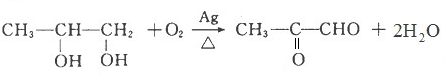 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
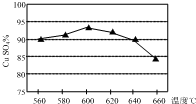 将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4•5H2O).| 粒子 | Cu2+ | Fe2+ | Fe3+ |
| 开始沉淀时的pH | 4.7 | 5.8 | 1.9 |
| 完全沉淀时的pH | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 973K | 1173K |
| K1 | 1.47 | 2.15 |
| K2 | 2.33 | 1.67 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com