
| 1 |
| 2 |
 ,故答案为:
,故答案为: .
.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案科目:高中化学 来源: 题型:
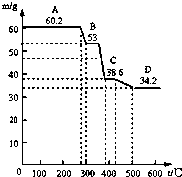 某校研究性学习小组取得了两种牌号的水滑石样品拟进行探究,请回答相关问题.
某校研究性学习小组取得了两种牌号的水滑石样品拟进行探究,请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BeCl2分子中各原子最外层均已满足8电子稳定结构 |
| B、第ⅡA族的某元素原子序数为x,则原子序数为x+1的元素不一定在第ⅢA族 |
| C、构成单质分子的粒子间一定存在化学键 |
| D、含有离子键的化合物不一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
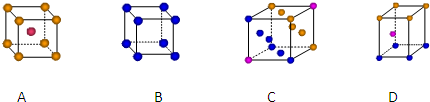
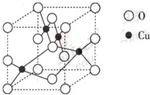
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液加入盐酸酸化的BaCl2溶液,若生成白色沉淀,则原溶液中一定含有SO42 |
| B、向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中滴几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
| C、向FeSO4溶液中加入NaOH,可以看到先出现白色沉淀,迅速变为灰绿色,最终变成红褐色 |
| D、不能用澄清的石灰水来鉴别Na2CO3和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态 |
| B、同一原子中,2p,3p,4p能级的轨道依次增多 |
| C、所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同 |
| D、CH2O和ClO4-的中心原子上都含有孤对电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com