
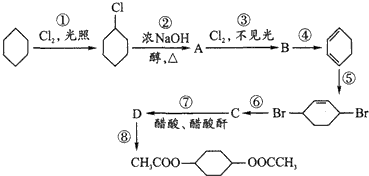
 在氢氧化钠醇作用下发生消去反应生成A,A为
在氢氧化钠醇作用下发生消去反应生成A,A为 ,
, 与氯气发生加成反应生成B,B为
与氯气发生加成反应生成B,B为 ,
, 发生消去反应生成
发生消去反应生成 ,
, 与溴水发1,4加成生成
与溴水发1,4加成生成 ,
, 发生水解生成C,C为
发生水解生成C,C为 ,
, 与醋酸酐发生酯化反应生成D,D为
与醋酸酐发生酯化反应生成D,D为 ,
, 与氢气发生加成反应生成
与氢气发生加成反应生成 .
. 在氢氧化钠醇作用下发生消去反应生成A,A为
在氢氧化钠醇作用下发生消去反应生成A,A为 ,
, 与氯气发生加成反应生成B,B为
与氯气发生加成反应生成B,B为 ,
, 发生消去反应生成
发生消去反应生成 ,
, 与溴水发1,4加成生成
与溴水发1,4加成生成 ,
, 发生水解生成C,C为
发生水解生成C,C为 ,
, 与醋酸酐发生酯化反应生成D,D为
与醋酸酐发生酯化反应生成D,D为 ,
, 与氢气发生加成反应生成
与氢气发生加成反应生成 .
. ;C的结构简式为:
;C的结构简式为: ;
; 发生消去反应生成
发生消去反应生成 的反应条件是浓氢氧化钠、醇、加热;
的反应条件是浓氢氧化钠、醇、加热; ;
; ;浓氢氧化钠、醇、加热.
;浓氢氧化钠、醇、加热.


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配料 | 氯化钠、碘酸钾 |
| 含碘量 | 20~30mg/1Kg |
| 保质期 | 18个月 |
| 食用方法 | 勿长时间炖炒 |
| 贮藏指南 | 避热、避光、密封、防潮 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
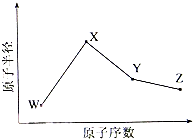 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最大.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com