
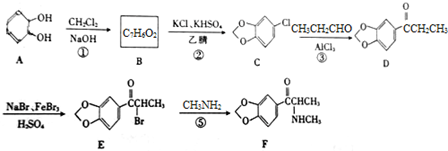
 ;
; (填结构简式);
(填结构简式); )的合成路线.
)的合成路线. 分析 (1)根据A的结构可知其分子式为C6H6O2,比较A和C的结构简式及转化条件可知,B为 ;
;
(2)根据D的结构简式可知其所含官能团名称;
(3)比较E和F的结构简式可知,反应⑤为E与氨基甲烷发生取代,E中的溴原子被取代生成F;
(4)根据条件a.属于芳香族化合物,说明含有苯环,b.能与NaOH溶液反应,说明有酚羟基或羧基可酯基,c.结构中除苯环外不含其他环状结构,结合(1)中分析得的B的结构可判断同分异构体的种类,其中核磁共振氢谱显示只有4组峰,说明有4种位置的氢原子,且不能发生银镜反应说明没有醛基,据此可写出B的同分异构体的结构简式;
(5)以苯和乙醛为原料制备香料2-羟基苯乙酮,可以用苯与氯气发生取代生成氯苯,氯苯与乙醛反应生成苯乙酮,苯乙酮在溴化钠、溴化铁、硫酸的作用下生成2-溴苯乙酮,2-溴苯乙酮水解得2-羟基苯乙酮( ),据此答题;
),据此答题;
解答 解:(1)根据A的结构可知其分子式为C6H6O2,比较A和C的结构简式及转化条件可知,B为 ,
,
故答案为:C6H6O2; ;
;
(2)根据D的结构简式可知D中含氧官能团的名称为羰基和醚键,
故答案为:羰基和醚键;
(3)比较E和F的结构简式可知,反应⑤为E与氨基甲烷发生取代,E中的溴原子被取代生成F,
故答案为:取代反应;
(4)B为 ,根据条件a.属于芳香族化合物,说明含有苯环,b.能与NaOH溶液反应,说明有酚羟基或羧基可酯基,c.结构中除苯环外不含其他环状结构,则符合条件的同分异构体为苯环上连有-OOCH或苯环上连有-CHO、-OH,有邻间对三种,或苯环上连有-COOH,共有5种类,其中核磁共振氢谱显示只有4组峰,说明有4种位置的氢原子,且不能发生银镜反应说明没有醛基的B的同分异构体的结构简式为:
,根据条件a.属于芳香族化合物,说明含有苯环,b.能与NaOH溶液反应,说明有酚羟基或羧基可酯基,c.结构中除苯环外不含其他环状结构,则符合条件的同分异构体为苯环上连有-OOCH或苯环上连有-CHO、-OH,有邻间对三种,或苯环上连有-COOH,共有5种类,其中核磁共振氢谱显示只有4组峰,说明有4种位置的氢原子,且不能发生银镜反应说明没有醛基的B的同分异构体的结构简式为: ,
,
故答案为:5; ;
;
(5)以苯和乙醛为原料制备香料2-羟基苯乙酮,可以用苯与氯气发生取代生成氯苯,氯苯与乙醛反应生成苯乙酮,苯乙酮在溴化钠、溴化铁、硫酸的作用下生成2-溴苯乙酮,2-溴苯乙酮水解得2-羟基苯乙酮( ),反应的合成路线为
),反应的合成路线为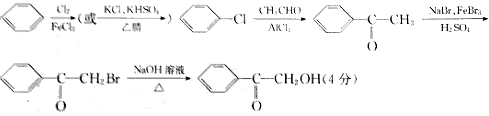 ,
,
故答案为: .
.
点评 本题考查有机物推断与合成,侧重考查分析、推断能力,难度中等,正确推断B结构及根据条件书写同分异构体是解本题关键,注意利用流程中的信息进行有机合成路线的设计,注意有机基础知识的灵活运用.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入较多NaHSO4的溶液中:Fe3+、Cl-、NO3-、Na+ | |
| B. | 通入大量CO2气体的溶液中:Na+、Ba2+、Cl-、NO3- | |
| C. | 通入大量NH3的溶液中:Ca2+、Na+、HCO3-、Cl- | |
| D. | 通入大量SO2气体的溶液中:Na+、SO32-、NH4+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8 kJ•mol-1,则H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 已知:S(g)+O2(g)═SO2(g)△H1=-Q1;S(s)+O2(g)═SO2(g)△H2=-Q2,则Q1<Q2 | |
| C. | 已知:$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1; CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)△H2,则有|△H1|<|△H2| | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJ•mol-1 CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 C(石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com