
下列电离方程式正确的是( )
A.NaHSO4 Na++HS Na++HS |
B.NaHCO3 Na++H++C Na++H++C |
C.H3PO4 3H++P 3H++P |
D.HF H++F- H++F- |
科目:高中化学 来源:2013-2014广西桂林市、崇左市、防城港市、北海市高三化学试卷(解析版) 题型:选择题
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如右图所示。下列说法正确的是

A、电池放电时Na+从a极区移向b极区
B、每消耗6molH2O2转移电子6mol
C、电极a采用MnO2,MnO2既作电极又有催化作用
D、该电池的负极反应为:BH4-+2H2O-8e-=BO2-+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.乙烷和乙烯均可使酸性KMnO4溶液褪色 |
| B.纤维素、淀粉和蛋白质都是高分子化合物 |
| C.煤的干馏和石油的分馏均属化学变化 |
| D.酯类和糖类均能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
A、B、C、D均是短周期元素,A和B同周期, B和C同族,A元素族序数是周期数的三倍,B原子最外层电子数是内层电子数的二倍,B与A能生成化合物BA2,C与A生成化合物CA2, A的阴离子与D的阳离子电子层结构相同,都与氖原子的电子层结构相同,D 的单质与A 的单质在不同条件下反应,可生成D2A或D2A2。请回答
(1)写出元素符号A: ,B: ,C: 。
(2)D2A的电子式 ,BA2的结构式 。
(3)D2A2的化学式 ,灼烧这化合物火焰呈 色。
(4)C在元素周期表中的位置是 ,其原子结构示意图为 。
(5)比较A、B气态氢化物的沸点 ;原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(27分)氨的合成原理为:N2(g)+3H2(g)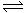 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题: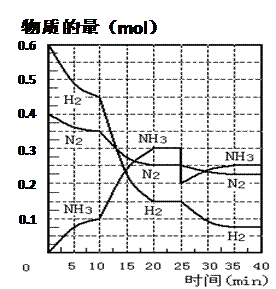
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加NH3物质的量 |
 2NH3(g) +
2NH3(g) + 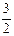 O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com