
【题目】设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.常温下64 g S4和S8混合物中含有原子数为2NA
B.标准状况下,22.4L水中含电子数为10 NA
C.l L1 mol/L的盐酸溶液中,所含氯化氢分子数为NA
D.56 g Fe 与足量氯气反应,转移的电子数为 2 NA
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.往碘化亚铁中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B.氯气与水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C.硝酸银溶液中加入过量氨水:Ag+ +NH3·H2O=AgOH↓+NH4+
D.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于配制980mL,0.1mol·![]() 的
的![]() 溶液的实验,下列说法正确的是
溶液的实验,下列说法正确的是
A. 需要称取![]() 固体的质量为16.0g
固体的质量为16.0g
B. 一定用到的玻璃仪器有 1000 mL 的容量瓶、烧杯、玻璃棒、漏斗、胶头滴管
C. 为加快![]() 固体的溶解,可适当加热,然后趁热将溶液转移到容量瓶中
固体的溶解,可适当加热,然后趁热将溶液转移到容量瓶中
D. 倒转摇匀后发现液面低于刻度线,若补加蒸馏水至刻度线会使所得溶液的浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 与丙三醇互为同系物
与丙三醇互为同系物
B. ![]() 与
与![]() 的单体相同
的单体相同
C. 淀粉、蛋白质、光导纤维均为有机高分子化合物
D. 按系统命名法,化合物![]() 的名称为2-甲基-3,4-乙基己烷
的名称为2-甲基-3,4-乙基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5mol/L Li2SO4水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是( )
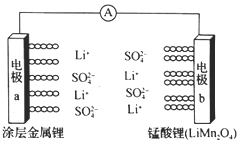
A.该电池放电时,溶液中的SO42-向电极b移动
B.该电池负极的电极反应式为:2Li+2H2O=2LiOH+H2↑
C.电池充电时,阳极的电极反应式为:Li2Mn2O4-e-=LiMn2O4+Li+
D.电池充电时,外加直流电源的正极与电极a相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金中含有镁、铜、铝三种金属,现取10.0g 该铝合金,向其中加入100mL 3.0mol/L 氢氧化钠溶液,氢氧化钠溶液恰好完全反应,请计算:
(1)该铝合金中铝的质量分数________
(2)生成标准状况下的氢气的体积是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型纽扣电池在现代生活中有广泛应用。有一种银锌电池如图所示,电池总反应为:
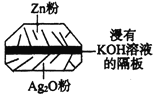
Zn + Ag2O + H2O = 2Ag + Zn(OH)2。下列叙述中正确的是( )
A.在使用过程中,电解质KOH不断被消耗
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.正极反应式为:Ag2O+H2O+2e- = 2Ag+2OH-
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
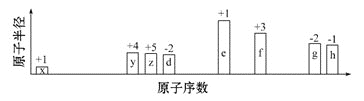
根据判断出的元素回答问题:
(1)f在周期表中的位置是____________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱________>________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:__________________。
(4)写出e的单质在足量d2中燃烧后的产物与y的高价氧化物反应的化学方程式:______。
(5)写出由x、y、z、d四种元素构成的离子化合物的化学式(写一种)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,微溶于水,酸性条件下不稳定,易生成金属 Cu 和Cu2+,广泛应用于化工和印染等行业。某研究性学习小组拟热分解 CuC122H2O 制备 CuCl,并进行相关探究。下列说法不正确的是( )
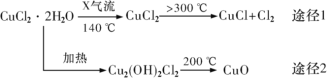
A.途径 1 中产生的Cl2 可以回收循环利用
B.途径 2 中 200℃时反应的化学方程式为:Cu2(OH)2Cl2![]() 2CuO+2HCl↑
2CuO+2HCl↑
C.X 气体是HCl,目的是抑制 CuCl22H2O 加热过程可能的水解
D.CuCl 与稀硫酸反应的离子方程式为:2Cu++4H++SO42-═2Cu2++SO2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com