
【题目】下图是部分短周期元素的常见化合价与原子序数的关系:
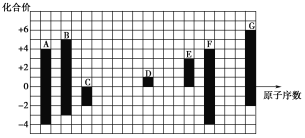
(1)元素A在周期表中的位置为________________________。
(2)用电子式表示D2G的形式过程:__________________________________,其所含化学键类型为__________。
(3)C2-、D+、G2-半径由大到小的顺序是________(填离子符号)。
(4)C、G的简单氢化物中,沸点较低的是________(填化学式),原因是________________。两种气态氢化物的稳定性C________G(填“>”或“<”)。
(5)C与D形成的具有强氧化性的化合物的电子式为________。
【答案】第2周期ⅣA族![]() 离子键S2->O2->Na+H2S水分子间存在氢键>
离子键S2->O2->Na+H2S水分子间存在氢键>![]()
【解析】
由图中化合价可知,A、F的化合价都为+4、-4,二者位于同主族,且F的原子序数较大,故A为C元素、F为Si元素;C的化合价为-2,没有正化合价,故C为O元素;D的化合价为+1,处于第ⅠA族,原子序数大于O元素,故D为Na元素;E的化合价为+3,为Al元素;G的最高正价为+6、最低负价为-2,为S元素;B的化合价有+5、-3,处于第ⅤA族,原子序数介于C、O之间,则B为N元素。(1)A为C元素,位于周期表中第2周期ⅣA族。(2)Na2S属于离子化合物,含有离子键。(3)电子层结构相同时,核电荷数越大,离子半径越小;电子层结构不同时,电子层越多,离子半径越大,即离子半径S2->O2->Na+。(4)H2O分子间存在氢键,所以水的沸点高于H2S;非金属性O>S,所以H2O的稳定性强于H2S。(5)C与D形成的具有强氧化性的化合物是过氧化钠,其电子式为![]() 。
。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】以某铬矿石(主要成分是Cr2O3,含FeO、SiO2等杂质)为原料生产Cr2O3的流程如下:
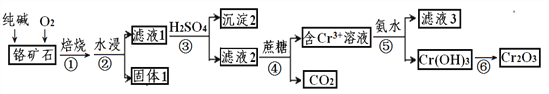
已知:Cr2O72-+H2O![]() 2CrO42-+2H+,Ksp[Cr(OH)3] =6.4×10-31,lg2 = 0.3
2CrO42-+2H+,Ksp[Cr(OH)3] =6.4×10-31,lg2 = 0.3
(1)步骤①中为了提高反应速率应该采取的措施有____、_____。(写2种)
(2)焙烧时Cr2O3被氧化成Na2CrO4,配平下面的化学方程式,并用单线桥表示电子转移的方向和数目:
Na2CO3+ Cr2O3+ O2![]() Na2CrO4 + CO2,______________
Na2CrO4 + CO2,______________
(3)流程中沉淀2为_________(填化学式)
(4)步骤④发生的反应中Cr2O72-和蔗糖(C12H22O11)的物质的量之比为_____。
(5)步骤⑤中为了使Cr3+完全沉淀[此时,c(Cr3+)≤10-5mol·L-1],pH至少调至____。
(6)滤液3中的主要溶质是两种盐,化学式为_________、________。
(7)另一种制取Cr(OH)3的工艺是将NaCrO2溶解后通入CO2得到更为纯净的Cr(OH)3,则NaCrO2溶液与过量CO2反应的离子方程式为_____________________。。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对已达化学平衡的下列反应:2X(g)+Y(g) ![]() 2Z(g)△H>0;降低温度的同时减小压强,对反应产生的影响是
2Z(g)△H>0;降低温度的同时减小压强,对反应产生的影响是
A. 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B. 逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C. 正、逆反应速率都减小,平衡向逆反应方向移动
D. 正、逆反应速率都减小,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不符合现代大爆炸宇宙学理论的是( )
A.我们所在的宇宙诞生于一次大爆炸
B.恒星正在不断地合成自然界中没有的新元素
C.氢、氦等轻核元素是宇宙中天然元素之母
D.宇宙的所有原子中,最多的是氢元素的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2O与CO2互为等电子体.下列关于N2O的说法正确的是( )
A. N2O的空间构型与CO2构型不同
B. N2O的空间构型与H2O构型相似
C. N2O的空间构型与NH3构型相似
D. N2O的空间构型为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下1molC3H8发生如下反应:①C3H8→C2H4+CH4②C3H8→C3H6+H2如果C3H8的转化率为80%,且混合气体中m(CH4)=m(H2),则下列说法正确的是( )
A. 反应后混合气体的平均相对分子质量为35.2
B. 两种烯烃物质的量之比,即n(C2H4)/n(C3H6)为1∶1
C. 将混合气体通入溴的四氯化碳溶液,溶液增重128g
D. 两种烯烃物质的量之和,即n(C2H4)+n(C3H6)为0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2) 和亚硫酰氯(SOCl2) 均是重要的化工试剂,遇水发生剧烈反应,常用作脱水剂。
已知:①SO2Cl2 (g)![]() SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
SO2(g)+Cl2(g) △H= +471.7kJ/mol; 平衡常数K1
②SO2(g) +Cl2(g) +SCl2(g)![]() 2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
2SOCl2(g) △H=-477.3kJ/mol; 平衡常数 K2
(1)反应2SOCl2(g)![]() SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
SO2Cl2(g)+SCl2(g)的平衡常数K=_____(用K1、K2表示) 该反应△H=_____kJ/mol。
(2)若在绝热、恒容的密闭容器中,投入一定量的SO2Cl2(g)和SCl2(g),发生反应SO2Cl2(g)+SCl2(g)![]() 2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。
2SOCl2(g),下列示意图能说明t1时刻反应达到平衡状态的是____(填序号)。

(3)为研究不同条件对反应①的影响,在恒温条件下,向2L恒容密闭容器中加入0.2molSO2Cl2,10min后反应①达到平衡。测得10min内v(SO2)= 8.0×10-3mo1·L-1·min-1,则平衡时SO2Cl2的转化率α1=_______。若其它条件保持不变,反应①在恒压条件下进行,平衡时SO2Cl2的转化率α2_____α1(填“>”、“<”或“=”)。若要增大SO2Cl2的转化率,可以采取的措施有______(列举一种)。
(4)锂亚硫酰氯(Li/SOCl2) 电池是一种大容量电池,该电池用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4) 溶解在亚硫酰氣(SOCl2)中形成的,其电池总反应方程式为:8Li+3SOCl2=6LiCl+Li2SO3+2S。
①写出电池工作时正极的电极反应式_____________;
②若用此电池做电源,以铂作电极电解200mL 0.2mol.L-1CuSO4溶液,当两极各产生标准状况下896mL的气体时,电池负极消耗锂的质量是______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表有个横行,叫周期,每一周期中元素原子的相同,元素周期表中有列,第ⅥA族处在第列,同一主族从上到下,元素的非金属性依次(填增强或减弱).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com