
【题目】已知下表数据:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-33 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | ≥3.4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不正确的是
A. 向该混合溶液中逐滴加入NaOH溶液: 最先看到红褐色沉淀
B. 该溶液中c(SO42-): [c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C. 向该溶液中加入适量氯水,并调节pH到4后过滤,可获得纯净的CuSO4溶液
D. 在:pH=5的溶液中Fe3+不能大量存在
【答案】C
【解析】A. 向混合溶液中逐滴加入NaOH溶液,开始生成Fe(OH)3时pH最小,所以最先看到红褐色沉淀,故A正确;B. 该溶液中c(SO42-)=2.5mol/L,由于Cu2+、Fe2+、Fe3+发生水解反应,使得c(Cu2+)+c(Fe2+)+c(Fe3+)<2.0mol/L,因此,c(SO42-):[c(Cu2+)+ c(Fe2+)+c(Fe3+)]>5:4,故B正确;C. 向该溶液中加入适量氯水,Fe2+被氧化为Fe3+,溶液中含有氯化物,不能获得纯净的CuSO4溶液,故C不正确;D. 在pH=5的溶液中c(OH-)=1×10-9mol/L,Fe3+被完全沉淀时,c(Fe3+)≤1×10-5mol/L,c(OH-)≥( =(
=(![]() <1×10-9mol/L,所以在pH=5的溶液中.Fe3+不能大量存在,故D正确。故选C。
<1×10-9mol/L,所以在pH=5的溶液中.Fe3+不能大量存在,故D正确。故选C。


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.工业上以NH3、CO2为原料生产尿素[CO(NH2)2],该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)===H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)===CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
(1)写出工业上以NH3、CO2为原料合成尿素的热化学方程式:___________
(2)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分的物质的量随时间的变化如下图所示:

已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_________步反应决定,总反应进行到_________min时到达平衡。
Ⅱ.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种。

猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……。
(3)猜想Ⅱ可能是:______________________
(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、 1mL 0.05mol/L 酸性KMnO4, 少量_______固体 |
实验现象 | 褪色时间10min | 褪色时间____10min (选填“<” “>”或 “=”) |
结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生设计了三个实验方案,用以检验淀粉的水解情况。
方案甲:淀粉液![]() 水解液
水解液![]() 中和液
中和液![]() 溶液变蓝。
溶液变蓝。
结论:淀粉完全没有水解。
方案乙:淀粉液![]() 水解液
水解液![]() 无银镜现象。
无银镜现象。
结论:淀粉完全没有水解。
方案丙:淀粉液![]() 水解液
水解液![]() 中和液
中和液![]() 有银镜现象。
有银镜现象。
结论:淀粉已经水解。
(1)淀粉的水解产物是______________________(填名称)。利用它的________________(填还原性或氧化性)可进行检验。
(2)方案甲结论不正确,正确结论应为淀粉可能完全没有水解或______________________________。
(3)方案乙结论也不正确,淀粉也可能部分或完全水解,因为__________________________________。
(4)方案丙的结论是正确的,其中最后一步的银氨溶液也可换成新制氢氧化铜悬浊液,则加热反应现象为_______________________________。
(5)若想进一步检验方案丙中淀粉是否完全水解,应取少量中和液,加______________,若现象为溶液变蓝,则证明淀粉__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 浓盐酸与铁屑反应:2Fe + 6H+= 2Fe3+ + 3H2↑
B. 往NH4HCO3溶液中加过量的NaOH溶液并加热:NH4+ + OH-=NH3↑ + H2O
C. 往酸性碘化钾溶液中滴加适量的双氧水:2I- + 2H+ + H2O2 =I2 + 2H2O
D. HS-的电离:HS- + H2O = H3O+ + S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~I分别表示中学化学中常见的一种物质,它们之间相互转化关系如图所示(部分反应物、生成物没有列出),且已知A、B、C、D、E、F六种物质中均含同一种元素,A、I是两种常见的金属单质.H在常温下是一种常见的非金属气态单质.
请填写下列空白:
(1)写出C、G物质的化学式.
C
G
(2)写出反应①、⑥的化学方程式和反应④的离子方程式.
反应①:
该反应通常叫做反应.
反应⑥:
反应④: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平.
请回答下列问题:
(1)鉴别甲烷和乙烯的试剂是(填选项字母).
A.稀硫酸
B.溴的四氯化碳溶液
C.水
D.酸性高锰酸钾溶液
(2)下列物质中,不能通过乙烯加成反应得到的是(填选项字母).
A.CH3CH3
B.CH3CHCl2
C.CH3CH2OH
D.CH3CH2Br
(3)已知2CH3CHO+O2 ![]() 2CH3COOH.若以乙烯为主要原料合成乙酸,其合成路线如下所示:
2CH3COOH.若以乙烯为主要原料合成乙酸,其合成路线如下所示:
乙烯 ![]() A
A ![]() B
B ![]() 乙酸,反应②的化学方程式为 .
乙酸,反应②的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用下图装置制取并探究氯气的性质。[A装置中发生反应的化学方程式:2KMnO4+16HCl(浓) == 2KCl+2MnCl2 + 5Cl2↑+ 8H2O ]

【实验探究】
(1)A装置中a仪器的名称是_____________。
(2)制取氯气反应中KMnO4所起的作用是_____(填“氧化剂”或“还原剂”)。
(3)实验进行一段时间后,可观察到______(填“B”或“C”)装置中有色布条褪色,其褪色原因是______________________________________。
(4)当氯气进入D装置后,可观察到溶液颜色变为_______(填“红色”或“蓝色”),写出相关反应的化学方程式___________________________________。
(5)E装置中NaOH溶液的作用是_____________________________________。
(6)用31.6 g KMnO4固体与足量的浓盐酸反应,最多可生成标准状况下_____L氯气。(KMnO4的摩尔质量为158 g·mol—1)
【知识拓展】
(7)近年来,某些含氯的化合物(如ClO2、NaClO等)在生产、生活中应用广泛。
①高效净水剂ClO2中氯元素的化合价为_____________。
②NaClO是一种强氧化剂。某种家用洗涤剂含有NaClO,请写出NaClO在洗涤过程中的一种作用___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( ) 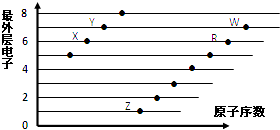
A.X和R在同一周期
B.原子半径:W>R>X
C.气态氢化物的稳定性:Y>X
D.X,Z形成的化合物中只有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.实验室制备氢氧化铁胶体时,采用的方法是向沸水中滴加硫酸铁溶液
B.工业硝酸呈黄色的原因是混有铁离子
C.制硫酸工业生产中,尾气中含有的二氧化硫可用亚硫酸钠溶液吸收
D.2CaSO4H2O是生石膏,可用作制作石膏绑带
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com