
| A. | 含一个叁键的直链有机物 | B. | 含有两个双键的直链有机物 | ||
| C. | 含一个双键的环状有机物 | D. | 只含单键且两个环的环状有机物 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:解答题
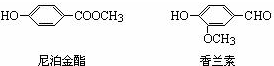
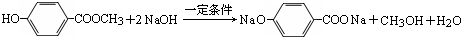 .
.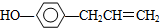 ,下列叙述中正确的是A(填序号)
,下列叙述中正确的是A(填序号)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电器着火,立即用水烧灭 | B. | 煤气泄漏,立即开灯查看 | ||
| C. | 房间着火,立即开窗通风 | D. | 油锅着火,立即盖上锅盖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁元素在反应①中被氧化,在③中被还原 | |
| B. | 反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 | |
| C. | 氧化性强弱顺序为:Cl2>I2>Br2>Fe3+ | |
| D. | 还原性强弱顺序为:I->Fe2+>Br->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| B. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| C. | 在石油分馏的实验中,需要在蒸馏烧瓶中加入碎瓷片 | |
| D. | 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电镀时,通常把待镀的金属制品作阳极 | |
| B. | 氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 | |
| C. | 氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-═2H2O | |
| D. | 工业冶炼金属铝的方法是电解熔融的氯化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol H2完全燃烧生成液态水时放出571.6kJ的热 | |
| B. | 1 mol H2完全燃烧生成液态水时放出285.8kJ的热 | |
| C. | 2 个H2分子完全燃烧生成液态水时放出571.6kJ的热 | |
| D. | 上述热化学方程式可以表示为:H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com