
| A. | 25℃时,向饱和MgF2溶液中加入饱和NaOH溶液后,不可能有Mg(OH)2生成 | |
| B. | 25℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者c(Mg2+)大 | |
| C. | 25℃时,Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp相比较,前者小 | |
| D. | 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大 |
分析 氢氧化镁与氟化镁的化学式相似,由题中数据可知氢氧化镁的溶度积小,其饱和溶液中Mg2+浓度较小;氢氧化镁存在着微弱的电离,产生的氢氧根和氯化铵电离出来的铵根结合,产生一水合氨,使平衡正向移动,所以镁离子的浓度增加,Ksp只与温度有关,以此解答该题.
解答 解:A.因氢氧化镁溶度积比MgF2的小,所以向饱和MgF2溶液中加入饱和NaOH溶液后,如满足Qc>Ksp,则有Mg(OH)2生成,故A错误;
B.氢氧化镁与氟化镁的化学式相似,因氢氧化镁溶度积小,则氢氧化镁溶液中Mg2+浓度小,故B错误;
C.Ksp不随浓度变化,只与温度有关,所以Mg(OH)2固体在同体积同浓度的氨水和NH4Cl溶液中的Ksp相比较,二者相同,故C错误;
D.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,NH4+结合OH-使氢氧化镁溶解平衡正向移动,c(Mg2+)增大,故D正确.
故选D.
点评 本题考查难溶电解质的溶解平衡和沉淀转化,为高频考点,侧重考查学生的分析能力,题目难度不大,注意比较两种物质的溶度积大小,特别注意不同物质的溶度积比较应是在化学式相似的情况下才有可比性.


科目:高中化学 来源:2016-2017学年山东省高二上10月月考化学试卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.Na2CO3俗称纯碱,属于盐类,可用于洗涤油污等
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.电解MgCl2饱和溶液,可制得金属镁
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
下列实验操作能达到实验目的的是( )
选项 | 实验目的 | 实验操作 |
A | 除去CO2中少量的CO | 点燃 |
B | 除去CuSO4溶液中的少量FeSO4 | 加入足量的铜粉 |
C | 鉴别澄清石灰水和NaOH溶液 | 加入稀盐酸 |
D | 鉴别硬水和软水 | 加入肥皂水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
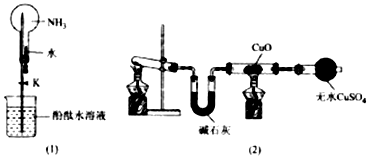
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | s电子云是在空间各个方向上延展程度相同的对称形状 | |
| B. | p电子云是“8”字形的 | |
| C. | 2p能级有一个未成对电子的基态原子的电子排布式一定为1s22s22p5 | |
| D. | 2d能级包含5个原子轨道,最多容纳10个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第3层最多能容纳32个电子 | |
| B. | 磷原子的结构示意图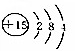 | |
| C. | 第2周期元素的最高正价从+1递增到+7 | |
| D. | 同周期主族元素的原子半径随原子序数的递增而逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y>Z>W | |
| B. | 最高价氧化物对应水化物的酸性:Y<Z | |
| C. | X分别与Y,Z形成的最简单化合物均属于电解质 | |
| D. | 工业上制备W单质的方法为电解熔融的W的氯化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应 | |
| B. | 原子半径大小关系:X>Y,Z<W | |
| C. | 化合物Z2Y和ZWY都只存在离子键 | |
| D. | Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com