
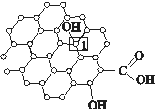
某有机化合物的结构简式为: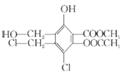 ,下列有关该物质的叙述正确的是
,下列有关该物质的叙述正确的是
A. 1 mol该物质最多可以消耗3 mol Na
B.1 mol该物质最多可以消耗7 mol NaOH
C.不能与Na2CO3溶液反应
D.易溶于水,可以发生加成反应和取代反应
科目:高中化学 来源: 题型:
获取知识和信息是现代人不可缺少的能力,信息产业的飞速发展离不开材料科学的推动,信息产业的核心材料是高纯度的硅。下面是高纯度单晶硅的生产方法一:
SiO2 Si(粗硅)
Si(粗硅)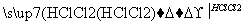 SiHCl3(沸点31.5 ℃)
SiHCl3(沸点31.5 ℃)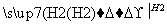 Si
Si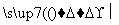 高纯硅→单晶硅
高纯硅→单晶硅
近代用得较多的另一种方法(方法二)是:用金属硅化物(Mg2Si)与盐酸作用制得硅烷(SiH4);再热分解硅烷可得高纯硅。单晶硅可用于制作大规模集成电路、整流器等,硅纯 度越高,大规模集成电路的性能越好。
度越高,大规模集成电路的性能越好。
(1)从方法一生产单晶硅的过程看,由碳还原得到的硅为何还要进一步处理?
(2)写出方法二中,生产高纯硅的两个化学方程式:
①________________________________________________________________________。
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是
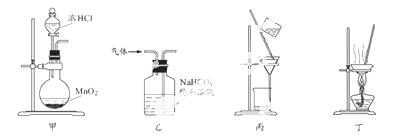
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A~F有如下转化关系:
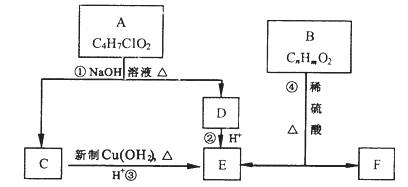
已知一个碳原子上连有两个羟基时不稳定,转化如下:
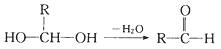
请回答:
(1)A的结构简式为: ;④的反应类型
(2)C与新制Cu(OH)2的化学方程式为
(3)已知B的摩尔质量为162g/mol,完全燃烧的产物中n(CO2):n(H2O)=2:1,B的分子式为 。
(4)F是生产高分子光阻剂的主要原料,特点如下:
①能发生加聚反应 ②含有苯环且苯环上一氯取代物只有两种 ③遇FeCl3显紫色
F与浓溴水反应的化学方程式
B与NaOH反应的化学方程式
(5)F的一种同分异构体G含苯环且能发生银镜反应。写出一种满足条件的G的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物G俗称PLA,在生产、生活用途前景广泛。它可由化合物A经过下列一系列反应制得,A中碳的质量分数为85.7%。
(已知含有醛基的有机物能与新制的氢氧化铜以及银氨溶液发生氧化还原反应)

(1)化合物F中所含官能团名称是_______________--。化合物H的结构简式___________________。
(2)在①—⑦的反应中,属于加成反应的有_________________。(填编号)
(3)写出符合下列条件的化合物E同分异构体__________________________。
①能与碳酸氢钠溶液反应,②能与银氨溶液反应
(4)写出反应③的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——选修3:物质结构与性质】(15分)
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示。
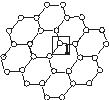
(a)石墨烯结构 (b)氧化石墨烯结构
(1)基态碳原子的核外电子有 种运动状态。
(2)图(a)中,1号C与相邻C形成σ键的个数为________。
(3)图(b)中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图(a)中1号C与相邻C形成的键角。

(4)若将图(b)所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
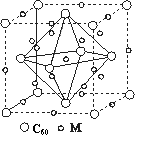
(5)石墨烯可转化为富勒烯分子(C60),C60属于________晶体,某
金属M与C60可制备一种低温超导材料,晶胞如图所示,M原子位
于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料
的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是 ( )
A.13C和14C属于同 一种元素,它们互为同位素
一种元素,它们互为同位素
B.1H和2H是不同的核素,它们的质子数相等
C.14C和14N的质量数相等,它们的中子数不等
D.6Li和7Li的核外电子数相等,中子数也相等
查看答案和解析>>
科目:高中化学 来源: 题型:
[选做题]本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,若两题都作答。将按A题评分。
A.【物质结构与性质】
可以由下列反应合成三聚氰胺:CaO+3C CaC2+CO↑,CaC2+N2
CaC2+CO↑,CaC2+N2  CN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
CN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式: 。 CaCN2中阴离子为CN ,根据等电子原理可以推知CN
,根据等电子原理可以推知CN 的空间构型为 。
的空间构型为 。
 (2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 。
(2)尿素分子中C原子采取 杂化。尿素分子的结构简式是 。
(3)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸( )
后,三聚氰酸与三聚氰胺分子相互之间通过 结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为 。
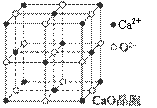

(5)CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致CaO比NaCl晶格能大的主要原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com