
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
|
| A. | 14g分子通式为CnH2n的链烃中含有的C═C的数目为 |
|
| B. | 标准状况下,NO和 O2各11.2L 混合,所得混合气体的分子总数为 0.75NA |
|
| C. | 25℃时,pH=7的NH4Cl和NH3•H2O混合溶液中,OH﹣离子数为10﹣7NA |
|
| D. | 两份2.7g铝分别与100mL浓度为2mol•L﹣1的盐酸和氢氧化钠溶液充分反应,转移的电子数均为0.3NA |
考点:
阿伏加德罗常数.
专题:
阿伏加德罗常数和阿伏加德罗定律.
分析:
A.分子通式为CnH2n的链烃的单烯烃,分子中含有1个碳碳双键,14gCnH2n的物质的量为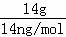 =
=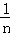 mol,含有
mol,含有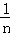 mol碳碳双键;
mol碳碳双键;
B.一氧化氮与氧气反应生成二氧化氮,部分二氧化氮转化成四氧化二氮,反应后的气体的分子总数减少;
C.缺少混合液的体积,无法计算溶液中氢氧根离子的物质的量;
D.2.7g铝的物质的量为0.1mol,0.1mol铝完全反应需要消耗0.3mol氯化氢,消耗氢氧化钠0.1mol,显然盐酸不足,转移的电子数目按照盐酸的物质的量的计算.
解答:
解:A.14gCnH2n的物质的量为: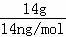 =
=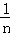 mol,所以14g该链烃中含有
mol,所以14g该链烃中含有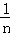 mol碳碳双键,含有的C═C的数目为
mol碳碳双键,含有的C═C的数目为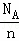 ,故A正确;
,故A正确;
B.标准状况下,11.2L气体的物质的量为: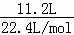 =0.5mol,0.5mol一氧化氮完全反应消耗0.25mol氧气,反应后还剩余0.25mol氧气,反应后气体的物质的量为0.75mol,由于部分二氧化氮转化成四氧化二氮,所以所得混合气体的物质的量小于0.75mol,所得混合气体的分子总数小于0.75NA,故B错误;
=0.5mol,0.5mol一氧化氮完全反应消耗0.25mol氧气,反应后还剩余0.25mol氧气,反应后气体的物质的量为0.75mol,由于部分二氧化氮转化成四氧化二氮,所以所得混合气体的物质的量小于0.75mol,所得混合气体的分子总数小于0.75NA,故B错误;
C.25℃时,pH=7的NH4Cl和NH3•H2O混合溶液中,氢氧根离子浓度为:10﹣7mol/L,由于缺少溶液体积,无法计算溶液中OH﹣离子数,故C错误;
D.100mL浓度为2mol•L﹣1的盐酸和氢氧化钠溶液中氯化氢、氢氧化钠的物质的量分别为:2mol/L×0.1L=0.2mol;2.7g铝的物质的量为: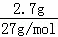 =0.1mol,0.1mol铝完全反应需要消耗0.3mol氯化氢、0.1mol氢氧化钠,显然氯化氢不足,铝与盐酸反应转移的电子的物质的量为0.2mol,与氢氧化钠溶液反应转移了0.3mol电子,二者转移的电子数目不同,故D错误;
=0.1mol,0.1mol铝完全反应需要消耗0.3mol氯化氢、0.1mol氢氧化钠,显然氯化氢不足,铝与盐酸反应转移的电子的物质的量为0.2mol,与氢氧化钠溶液反应转移了0.3mol电子,二者转移的电子数目不同,故D错误;
故选A.
点评:
本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意二氧化氮与四氧化二氮之间的转化关系,要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项D为易错点,注意根据题中数据判断反应物过量情况.


科目:高中化学 来源: 题型:
已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是( )
A. 16g B. 32g C. 64g/mol D. 32g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
第四周期元素的单质及化合物在工农业生产中应用广泛.
(1)第四周期元素中,基态原子的最外层只有1个电子的元素共有 种.元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.该元素的基态原子价电子排布为 .
(2)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是 (填序号).
A.氯化钙受热挥发 B.氯化钙受热分解
C.钙离子中电子跃迁 D.氯离子中电子跃迁
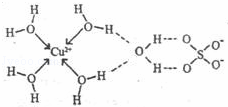
(3)无水硫酸铜呈白色,吸水后形成胆矾,呈蓝色.科学家通过X射线测定出胆矾的结构,其结构可用如图表示.
①胆矾晶体中除共价键、配位键及微弱的范德华力外,还存在的两种作用力是 和 .
②胆矾晶体CuSO4•5H2O可以写出[Cu(H2O)4]SO4•H2O,其中配位原子是 ,配位数是 .
③铜离子形成胆矾中配位离子的离子方程式为 .
④CO、NH3等也能与Cu+形成配合物.[Cu(NH3)n]+溶液可用于吸收合成氨原料气中的CO,加热吸收CO后的溶液又将放出CO.加热分解放出CO的过程中,必须克服微粒间的哪类作用力? .
⑤过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= .
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如右表.据表判断Mn2+和Fe2+再失去﹣个电子的难易,并从原子结构的角度简述其原因 .
| 元素 | Mn | Fe |
|
| 电离能kJ•mol﹣1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下有三组混合物:①氯化钠和水;②硫酸钡和水;③煤油和水;④碘水的混合物.分离以上混合液的正确方法依次是( )
|
| A. | 分液、萃取、蒸馏、过滤 | B. | 蒸发、过滤、分液、萃取 |
|
| C. | 分液、蒸发、萃取、过滤 | D. | 蒸馏、萃取、分液、蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:
完成下列反应的离子方程式:
①碳酸钙溶于醋酸中 ;
②向稀氨水中加入稀盐酸 ;
③向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式: ;在以上中性溶液中继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
)用右图所示装置进行如下实验,能达到实验目的是( )
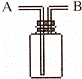
|
| A. | 瓶中盛满水,从B口进气,用排水法收集NO2 |
|
| B. | 瓶中盛适量浓硫酸,从A口进气来干燥NH3 |
|
| C. | 从B口进气,用排空气法收集CO2 |
|
| D. | 瓶中装满水,A口连导管并伸入量筒中,从B口进气,用排水法测量生成H2的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作及装置合理并能达到实验目的是( )
|
| A. |
制取并收集氨气 |
|
| B. | . 收集并测定氧气的体积 |
|
| C. | . 制乙酸乙酯 |
|
| D. | . 用苯分离出碘水中的碘单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Al,Fe,Cu都是重要的金属元素.下列说法正确的是( )
|
| A. | 三者对应的氧化物均为碱性氧化物 |
|
| B. | 三者的单质放在空气中只生成氧化物 |
|
| C. | 制备AlCl3,FeCl2,CuCl2均可用单质直接化合的方法 |
|
| D. | 三者对应的最高价氢氧化物均不能由对应的氧化物和水反应得到 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com