
| A. | 标准状况下,22.4LHF中的原子数目为2NA | |
| B. | 在18 g18O2中含有NA个氧原子 | |
| C. | 常温常压下,17g的NH3含有的电子数为10NA | |
| D. | NA 个CO2分子中含有4mol极性键 |
分析 A、标况下HF为液态;
B、18O2的相对分子质量为36,结合n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算;
C.物质的量n=$\frac{m}{M}$,1个氨气分子含10个电子;
D、二氧化碳是直线型分子,分子中含有两个碳氧双键.
解答 解:A、标况下HF为液态,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、18O2的相对分子质量为36,n(18O2)=$\frac{18g}{36g/mol}$=0.5mol,则含有1mol18O原子,个数为NA,故B正确;
C.17g的NH3分子物质的量=$\frac{17g}{17g/mol}$=1mol,1mol氨气分子中含有的电子数为10NA,故C正确;
D、二氧化碳是直线型分子,分子中含有两个碳氧双键,所以1molCO2分子中含有4mol极性键,故D正确;
故选A.
点评 本题考查了阿伏伽德罗常数的应用,主要是物质的量和微粒数的计算关系分析、气体摩尔体积的应用条件等知识,掌握基础是解题关键,题目难度不大.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 22.4LNH3分子中含有3NA个N-H键 | |
| B. | 2.3 g Na完全与O2反应生成3.6 g产物时失去的电子数为0.1NA | |
| C. | 1 L0.1 mol•L-1蔗糖溶液中所含分子数为0.1NA | |
| D. | 常温常压下,46g NO2含有的原子数小于3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
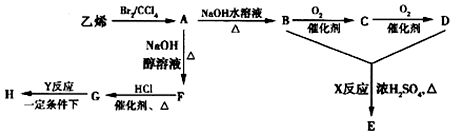
 +2H2O;
+2H2O; +2NaOH$\stackrel{△}{→}$NaOOCCOONa+HOCH2CH2OH.
+2NaOH$\stackrel{△}{→}$NaOOCCOONa+HOCH2CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷与氯气光照反应可以制得较纯净的1,2-二氯乙烷 | |
| B. | 苯中的化学键都是非极性键 | |
| C. | 煤的干馏属于物理变化 | |
| D. | 涤纶、酚醛树脂和蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
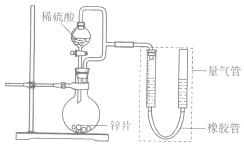 某同学设计计如图所示装罝(部分夹持装置己略去)进行实验探究:
某同学设计计如图所示装罝(部分夹持装置己略去)进行实验探究:| 序号 | V(H2SO4)/mL | C(H2SO4)/mol•L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 4 | t2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(s) 浓度(mol/L) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(CO) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaHCO3和Al2(SO4)3溶液可以制作泡沫灭火剂 | |
| B. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏 | |
| C. | 溴化银见光易分解,可用作胶片感光剂 | |
| D. | 硅胶多孔,常用作食品干燥剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径逐渐增大 | |
| B. | 单质氧化性逐渐增强 | |
| C. | 气态氢化物的稳定性逐渐增强 | |
| D. | 都有最高价氧化物的水化物,化学式为HXO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com