
某中学有甲、乙两个探究性学习小组,他们拟用小颗粒状铝硅合金与足量稀硫酸的反应测定通常状况(约20 ℃,1 atm)下气体摩尔体积。
(1)甲组同学拟选用下列实验装置完成实验:
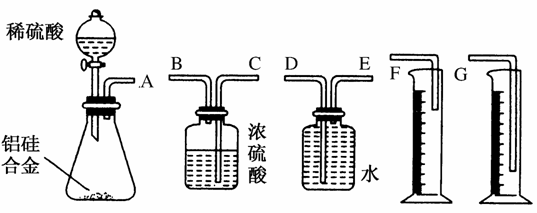
①该组同学必须选用的装置的连接顺序是A接( )、( )接( )、( )接( )(填接口字母,可不填满);
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸不能顺利滴入锥形瓶。请你帮助分析原因______________
_______________________________________________________________;
③实验结束时,该组同学应怎样测量实验中生成氢气的体积?
__________________________________________________________________________________________________________________________。
(2)乙组同学仔细分析甲组同学的实验装置后,认为:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了如下图所示的实验装置。
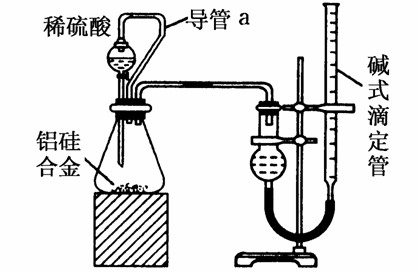
①装置中导管a的作用是:______________________________________
______________________________________________________________;
②实验中准确测得4个数据:实验前铝硅合金的质量为m1 g,实验后残留固体的质量为m2 g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则通常状况下气体摩尔体积Vm=________。
解析 本题通过测定一定物质的量的H2的体积来测定通常状况下气体摩尔体积。H2的物质的量可根据铝硅合金中铝的质量求算,H2的体积通过排水法测定。
(1)①干燥H2时要长进短出,排水测定H2体积时要短进长出,不选F装置的理由是F中导管太短,不能形成连通器,无法调整两容器内的液面高度,使广口瓶中和量筒中压强不等,产生误差。②由于反应放热且生成气体,锥形瓶中气体压强变大,所以稀硫酸不能顺利滴入锥形瓶。③测量H2体积时要注意两个问题:一是冷却,二是保证液面两侧压强相等。
(2)①a管可使分液漏斗内与锥形瓶内压强相等,从而使稀硫酸顺利滴下,还能够消除由于加入稀硫酸引起的氢气体积误差。
②m(Al)=(m1-m2)g,
所以n(H2)=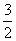 n(Al)=
n(Al)=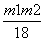 mol
mol
V(H2)=(V1-V2)mL,
所以Vm= =
=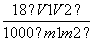 L/mol。
L/mol。
答案 (1)①C B E D G
②铝与稀硫酸反应放热且生成气体,使锥形瓶中气体压强变大
③待实验装置冷却后,上下移动量筒,使其中液面与广口瓶中液面相平,再平视读取量筒中水的体积,即氢气在通常状况下的体积
(2)①使分液漏斗内气体压强与锥形瓶内气体压强相等;打开分液漏斗活塞时稀硫酸能顺利滴下;滴入锥形瓶的稀硫酸体积等于进入分液漏斗的气体体积,从而消除由于加入稀硫酸引起的氢气体积误差
②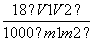 L/mol
L/mol


科目:高中化学 来源: 题型:
下列关于有机反应类型的说法错误的是( )
A.甲烷与氯气的反应属于取代反应
B.乙烯与氢气的反应属于加成反应
C.乙酸与乙醇的反应属于酯化反应
D.苯与硝酸的反应属于加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组元素性质递变情况错误的是( )
A.H、Be、B原子最外层电子数依次增多
B. P、S、Cl元素最高正化合价依次升高
C. B、C、N、O、F原子半径依次增大
D. Li、Na、K、Rb的金属性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数,下列说法中正确的是( )
①氯元素的相对原子质量一定是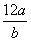 ②m g该氯原子的物质的量一定是
②m g该氯原子的物质的量一定是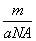 mol ③该氯原子的摩尔质量是aNA g/mol ④a g该氯原子所含质子数是17 mol
mol ③该氯原子的摩尔质量是aNA g/mol ④a g该氯原子所含质子数是17 mol
A.①③ B.②④
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作过程能引起实验结果偏高的是( )
①用已知浓度的盐酸滴定未知浓度的NaOH溶液时,酸式滴定管未用标准液润洗
②用量筒量取5.0 mL溶液时,俯视读数
③配制一定物质的量浓度的硫酸溶液,定容时仰视容量瓶的刻度线
④质量分数为10%和90%的两种硫酸等体积混合配制50%的硫酸溶液
A.①③ B.①④
C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)甲烷的分子个数为1.204×1023,则甲烷的物质的量为 mol,所含的原子个数共有 个,与这些甲烷质量相等的O2的物质的量为 mol。
(2)含有相同氧原子数目的NO和CO2两种气体,其质量比 ,物质的量比为 ,在标准状态下,体积比为 。
(3)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol。
①原NaOH溶液的质量分数为 。
②所得溶液中Cl-的物质的量为 mol。
③所用氯气和参加反应的氢气的物质的量之比n(Cl2)∶n(H2)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G都是链状有机物,它们的转化关系如图所示.A只含一种官能团,D的相对分子质量与E相差42,D的核磁共振氢谱图上有3个峰,且峰面积之比为1:3:6,请回答下列问题:
已知:Mr(R﹣Cl)﹣Mr(ROH)=18.5,Mr(RCH2OH)﹣Mr(RCHO)=2,Mr表示相对分子质量.
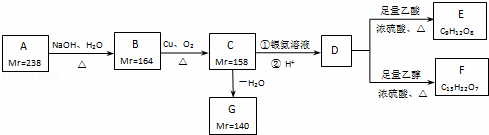
(1)A中含有的官能团是 .
(2)写出D的分子式 .
(3)下列有关A~G的说法正确的是 .
a.每个A分子中含有官能团的数目为4个
b.B中所有官能团均发生反应生成C
c.C生成G只有1种产物
d.G存在顺反异构现象
(4)写出B生成C的化学方程式 .
(5)芳香族化合物H与G互为同分异构体,1mol H与足量氢氧化钠溶液反应消耗2mol NaOH,且H苯环上的一氯代物只有两种,写出其中任意一个符合条件的H的结构简式 或 .
(6)E与足量NaOH溶液共热,此反应的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是

A.反应I2(aq)+I-(aq)=I3-(aq)的△H>0
B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C.若反应进行到状态D时,可能v正<v逆
D.状态A与状态B相比,状态 A的c(I2)大
A的c(I2)大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com