
��֪��H2(g)��F2(g)===2HF(g) �������仯��ͼ��ʾ�������й���������ȷ����
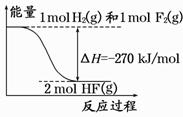
A������������ֽ����������ͷ����ķ�Ӧ�Ƿ��ȷ�Ӧ
B��1 mol H2��1 mol F2��Ӧ����2 molҺ̬HF�ų�������С��270 kJ
C������ͬ�����£�1 mol H2��1 mol F2�������ܺʹ���2 mol HF���������
D������1 mol H��H����1 mol F��F ���ų������������γ�2 mol H��F���ų�������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͬ�������������ʷֱ����Ũ�ȵ�NaOH��Һ��Ӧ������ϵ�о��������ʣ����ļ���������(����)
A��Al B��Al(OH)3
C��AlCl3 D��Al2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʲ���ͨ�����Ϸ�Ӧֱ���Ƶõ��ǣ�������
�� A�� FeCl2 B�� NaHSO3 C�� Cu��OH��2 D�� Na2O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�۲����о��������ʵ�һ�ֻ���������һͬѧ��һС�������¶���ڿ����У��۲쵽������������ɫ ��Ұ�
��Ұ� ���ɫ
���ɫ ����Һ��
����Һ��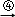 ��ɫ���壬����˵����ȷ���ǣ�������
��ɫ���壬����˵����ȷ���ǣ�������
| �� | A�� | �ٷ�����������ԭ��Ӧ |
| �� | B�� | �ڱ��ɫ����Ϊ������̼���� |
| �� | C�� | ����̼�������տ����е�ˮ�����γ�����Һ |
| �� | D�� | ��ֻ���������仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijУ����С��Ϊ�ⶨij̼���ƺ�̼�����ƻ������̼���Ƶ������������ס�������ͬѧ�ֱ�������������ʵ�飮[��֪Ba��HCO3��2������ˮ]
��������ͬѧ�ó�����������������ͼ��ʾ��ʵ�����̽���ʵ�飺
��1��ʵ��ʱ�����˲����У������ձ���©���⣬��Ҫ�õ��IJ�������Ϊ������
��2��ϴ�ӳ���B�IJ�����������
��3����ʵ���в����Ʒ����Ϊm g����������Ϊn g����̼���Ƶ���������Ϊ������
��4����ɺ�ij���Ӧ�����������������ƣ�����ȴ�������ٳ�����
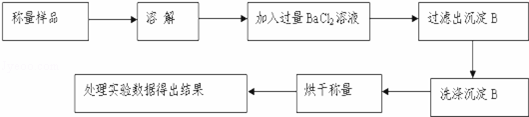
����������ͬѧ����Ҫʵ������ͼ���£�
������ͼ��ʾװ�ý���ʵ�飺
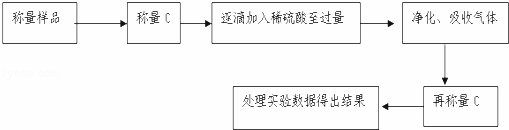
��5����ʵ����װ��Bʢ�ŵ���������������Һ©�����������������������������������ƫ����ƫС��������Ӱ�족����
��6����C��װ��ʯ�������վ���������壮Dװ�õ���������������
��7���е�ͬѧ��ΪΪ�˼���ʵ�����ڷ�Ӧǰ��ͨ��N2����Ӧ��ͨ��N2��Ŀ����������
���������������
��8����һ������Ʒ������ϡ���ᷴӦ������ͼװ�ò�������CO2����������B��Һ��ò�����������
��ѡ����ѡ��ʹ��������С��
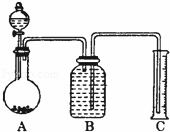
a����̼������Һ���� b����̼��������Һc��������������Һ������d��������ͭ��Һ
��9����ѡ�ø���Һ��ʵ������Ȼ����ȷ����ԭ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ӧ2H2S(g)  2H2(g)��S2(g)����H >0�������������䣬����˵����ȷ����
2H2(g)��S2(g)����H >0�������������䣬����˵����ȷ����
A�������������Ӧ·���������ı䣬��HҲ����֮�ı�
B�������¶ȣ����淴Ӧ���ʶ�����H2S�ֽ���Ҳ����
C������ѹǿ��ƽ�����淴Ӧ�����ƶ�����ϵ�¶Ƚ���
D��������ϵ������H2���´ﵽƽ���H2Ũ�Ƚ���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
I�����¶�ΪTʱ����2.0 L�����ܱ������г���1.0 mol A��1.0 mol B��������ӦA(g)��B(g)  C(g)��һ��ʱ���ﵽƽ�⡣�ⶨ�ò������ݼ��±���
C(g)��һ��ʱ���ﵽƽ�⡣�ⶨ�ò������ݼ��±���
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
�ش��������⣺
(1)��Ӧǰ5 s��ƽ����Ӧ����v(A) ��____________
(2)�¶�ΪTʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ����
(3)�����¶ȣ�ƽ��ʱc(A)��0.41 mol��L��1����Ӧ�Ħ�H ���� ��>0�� �� ��<0����
(4)��ͬ�¶��£���ʼʱ�������г���0.2 mol A��0.2 mol B��1.0 mol C����Ӧ�ﵽƽ��ǰ����Ӧ����v�� v��������>�� �� ��<����
(5)���д�ʩ������Ӧ���ʣ���ƽ��������Ӧ�����ƶ��� ��
a����ʱ�����A���� b���ʵ������¶�
c������B��Ũ�� d��ѡ���Ч����
II��NO��NO2�dz������������H2��CO����ԭNO�ɴﵽ������Ⱦ��Ŀ�ġ�
��֪��2NO(g) = N2(g) + O2(g) ��H = -180.5kJ��mol-1
2H2O(l) = 2H2(g) + O2(g) ��H = +571.6kJ��mol-1
����H2����ԭNO������Ⱦ���Ȼ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���������Ҫ�ɷֿɱ�ʾΪFeO·Cr2O3��������MgO��Al2O3��Fe2O3�����ʣ��������Ը�����Ϊԭ���Ʊ��ظ���أ�K2Cr2O7��������ͼ��

��������ش��������⣺
��1��������������� ������X����Ҫ���� ����д��ѧʽ����
��2���ô��������ҺpH=7��8���ٽ��в��������ù���Y�ijɷ�Ϊ ��д��ѧʽ��.
��3���ữ�����е�����ҺpH��5ʱ������Ӧ2CrO42����2H+�� Cr2O72����H2O.����������������ᣬ�������Cr2O72����Ӧ��ɴ�����Ⱦ������Cr3+���ʣ��÷�Ӧ�����ӷ���ʽΪ .
Cr2O72����H2O.����������������ᣬ�������Cr2O72����Ӧ��ɴ�����Ⱦ������Cr3+���ʣ��÷�Ӧ�����ӷ���ʽΪ .
��4���±���������ʵ��ܽ�����ݣ�����III������Ӧ�Ļ�ѧ����ʽ��
Na2Cr2O7+2KCl=K2Cr2O7��+2NaCl���÷�Ӧ����Һ���ܷ����������ǣ� ��

��5��������������ˮ���������ŷŶ��������滷���м����Σ������ⷨ�Ǵ�������Ⱦ��һ�ַ�������������������ʯī��������⺬Cr2O72-�����Է�ˮ��һ��ʱ������Fe(OH)3��Cr(OH)3������
 �ٵ�ⷨ������ˮ���ܷ�Ӧ���£���ƽ����д��ȱ��(��֪������n(Fe(OH)3): n (H2)=1:1)
�ٵ�ⷨ������ˮ���ܷ�Ӧ���£���ƽ����д��ȱ��(��֪������n(Fe(OH)3): n (H2)=1:1)
___Fe��___Cr2O72-��___ ��___H2O ��___Fe(OH)3����___Cr(OH)3����___H2����
����֪������Cr(OH)3��Ksp=6.4��10–32mol4/l4����������������ˮˮ�ʱ������������ֵ��0.052 mg/L��Ҫʹ��Һ��c(Cr3+)������������ˮˮ�ʱ����������Һ��pH����______������֪lg2=0.3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ҫ�õ��ϴ�������������壬�ڽᾧʱ�����²���
A�����Ʊ����¸�10��20������������ҺȻ��������ҵ�����С���ˣ����ù�ҹ
B���ڷ�ˮ����������������Һ��Ȼ������ȴ�ᾧ
C�������£�������������Һ��Ͷ������С���ˣ����ù�ҹ
D�����п�����������������Һ��������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com