
【题目】联合国大会将2019年定为“化学元素周期表国际年”,显示了元素周期律的重要性。下表列出了a~j10种元素在周期表中的位置:
周期 | IA | 0 | |||||||
1 | a | IIA | … | IIIA | IVA | VA | VIA | VIIA | |
2 | b | … | e | d | |||||
3 | c | f | … | g | h | i | j |
(1)因在元素b的电池材料领域做出了杰出贡献,97岁的古迪纳夫荣获2019年诺贝尔化学奖,b原子结构示意图为____;此类电池工作时,将___能转化为电能。
(2)a~j10种元素中,最外层电子数比K层电子数多的元素有___种(填数字);金属性最强的元素有_____(写元素符号)。
(3)元素g的最高价氧化物对应的水化物与NaOH溶液反应的离子方程式为:_______;
(4)h、i、j三种元素的气态氢化物中,最稳定的氢化物是______(写化学式);
(5)元素i的一种氧化物常用于漂白纸浆、草帽辫等。该氧化物具有还原性,在一定条件下能与常见氧化剂发生反应,写出其中一个反应的化学方程式:_______ 。
【答案】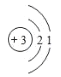 化学 6 Na Al(OH)3+OH-= AlO2-+2H2O HCl 2SO2+O2
化学 6 Na Al(OH)3+OH-= AlO2-+2H2O HCl 2SO2+O2![]() 2SO3或SO2+Cl2+2H2O=H2SO4+2HCl等
2SO3或SO2+Cl2+2H2O=H2SO4+2HCl等
【解析】
根据元素周期表可得元素a:H、b:Li、c:Na、d:F、e:B、f:Mg、g:Al、h:P、i:S、j:Cl。
(1) b为Li,核电荷数和核外电子数是3,所以原子结构示意图为 ;锂电池工作时,是原电池,原电池将化学能转化为电能。
;锂电池工作时,是原电池,原电池将化学能转化为电能。
(2) K层有2个电子,最外层电子数比K层电子数多的元素有F、B、Al、P、S、Cl,共有6种;同周期元素金属性从左到右逐渐减弱,同主族元素从上到下金属性逐渐增强,所以金属性最强的元素是Na;
(3) 元素g的最高价氧化物对应的水化物是Al(OH)3,Al(OH)3是两性氢氧化物,与碱反应生成盐和水,所以与NaOH溶液反应的离子方程式为Al(OH)3+OH-= AlO2-+2H2O;
(4)h、i、j三种元素的气态氢化物为PH3、H2S、HCl,同周期元素非金属性从左到右逐渐增强,非金属性越强,氢化物越稳定,最稳定的氢化物是HCl;
(5)元素i的一种氧化物SO2常用于漂白纸浆、草帽辫等。SO2具有还原性,能与氧化剂反应,如:2SO2+O2![]() 2SO3或SO2+Cl2+2H2O=H2SO4+2HCl等。
2SO3或SO2+Cl2+2H2O=H2SO4+2HCl等。


科目:高中化学 来源: 题型:
【题目】利用电化学原理可同时将SO2、CO2变废为宝,装置如图所示(电极均为惰性电极)。下列说法不正确的是
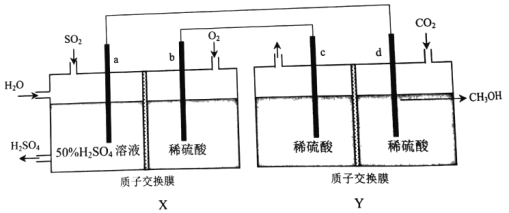
A. a为负极,发生氧化反应
B. 装置工作时,电子从c极流入b极
C. 若b极消耗16gO2,则Y中左侧溶液质量减轻16g
D. d电极反应式为CO2+6H++6e-=CH3OH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硼、氮、磷、铜、锌的化合物有许多重要用途。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为____;基态Cu+的核外电子排布式为___。
(2)![]() 的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因_______________。
的空间构型是________;HNO3的酸性比HNO2强,试从结构的角度解释其原因_______________。
(3)亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为____。
(4)Zn2+可与CN-、二苯硫腙(![]() )等形成稳定配合物。
)等形成稳定配合物。
①CN- 的结构式为_____。
②每个二苯硫腙分子中,采取sp2杂化的原子有__个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO+H+ ΔH>0。
CH3COO+H+ ΔH>0。
(1)常温常压下,在pH=5的稀醋酸溶液中,c(CH3COO)=__;(精确值)下列方法中,可以使0.10mol·L-1CH3COOH的电离程度增大的是___。
a.加入少量0.10mol·L1的稀盐酸 b.加热CH3COOH溶液 c.加入少量冰醋酸 d.加水稀释至0.010mol·L-1 e.加入少量氯化钠固体 f.加入少量0.10mol·L-1的NaOH溶液
(2)已知:90℃时,水的离子积常数为Kw=38×10-14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=___(保留三位有效数字)。
(3)现有浓度均为0.1mol/L的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨水,请回答下列问题:
ⅰ.①、②、③、④四种溶液中由水电离出的H+的浓度由大到小的顺序是(填序号)__。
ⅱ.④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)___。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人们在日常生活和工农业生产中应用极为广泛的一种金属。请回答下列问题:
(1)某研究性学习小组为了证明铁的金属性比铜的强,设计了如下几种方案,其中合理的有___(填序号)。
A.铁片置于硫酸铜溶液中置换出铜
B.铁、铜与氯气反应分别生成FeCl3、CuCl2
C.铜片置于FeCl3溶液中,铜片逐渐溶解
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片上无气泡产生
E.常温下,将铁片和铜片分别置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属性比铜的强的实验。要求:该实验方案的原理不同于(1)中任何一个方案。
①画出实验装置图并注明所需药品___。
②写出实验过程中的主要现象:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)如图是1 mol NO2和1 mol CO反应生成CO2 和NO过程中的能量变化示意图,请写出NO2 和CO反应的热化学方程式 _________________________________________。

(2)在0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数 K 与温度 T 的关系如下表:
T/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
请回答下列问题:
①试比较K1、K2的大小,K1 ______ K2(填“>”、“=” 或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据是_________(填序号字母)。
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.3v正(N2) = v逆(H2)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应 2NH3(g) ![]() N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
N2(g) + 3H2(g) 的平衡常数K为_________。当测得NH3、N2、H2的浓度分别为3 mol L1、2 mol L1、1 mol L1时,则该反应的v正(N2)______v逆(N2)(填“>”、“=” 或“<”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。
CH3OH(g)+H2O(g) ΔH=-58 kJ·mol1),在其他条件不变时,温度T1、T2对反应的影响图像如图。

①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=______mol·L1·min1。
②图示的温度T1______T2(填“>”、“=” 或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。

下列说法不正确的是
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H+ +O2↑
C.工业上将ClO2气体制成NaCIO2固体,其主要目的是便于贮存和运输
D.通入的空气的目的是驱赶出ClO2,使其被吸收其充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是( )
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积③、④溶液分别与NaOH完全反应,消耗NaOH物质的量:③>④
B.分别加水稀释10倍,四种溶液的pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液为碱性
D.VaL④溶液与VbL②溶液混合(近似认为混合溶液体积=Va+Vb),若混合后溶液pH=5,则Va︰Vb=9︰11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1mol产物的数据),根据下图回答下列问题:
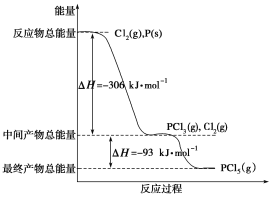
(1)PCl5分解生成PCl3和Cl2的热化学方程式____________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8molPCl5,反应达到平衡时还剩余0.6molPCl5,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率α2,α2________α1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是_________________________________________________。
(3)P和Cl2分两步反应生成1molPCl5的ΔH3=____________。
Ⅱ.某学生做浓度对化学反应速率的影响的实验时,将2支试管编号为①②,并按下表中物质的量进行实验,记录的时间数据是:16s、28s。请将2个数据填入下表的适当位置,并写出实验结论。
试管编号 | 加入3%Na2S2O3 | 加H2O | 加稀盐酸(1∶5) | 出现浑浊时间 |
① | 3mL | 3mL | 5滴 | a._____s |
② | 4mL | 2mL | 5滴 | b._____s |
(1)将对应①②的时间分别写出:a.____________,b.____________。
(2)实验结论____________________________________。
(3)写出反应的化学方程式_______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com