
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COOH-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3-HCO3-?H++HCO32- | K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS-HS-?H++S2- | K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4-H2PO4-H++HPO42- HPO42-?H++PO43- | K1=7.52×10-3K2=6.23×10-8 K3=2.20×10-13 |
分析 (1)弱电解质的电离是吸热反应,升高温度促进电离,根据反应物和生成物浓度的变化确定K的变化;
(2)K值越大,酸的电离程度越大;
(3)电离平衡常数越大的酸性越强,越小的酸性越弱;
(4)产生相同离子微粒间相互有抑制作用;
(5)Na2CO3溶液中碳酸根离子水解显碱性;
(6)NaH2PO4溶液中H2PO4-既水解又电离,以电离为主.
解答 解:(1)弱电解质的电离是吸热反应,升高温度促进弱电解质电离,则生成物浓度增大反应物浓度减小,所以K值增大,
故答案为:变大;
(2)K值越大,酸的电离程度越大,则溶液中氢原子浓度比氢氧根离子浓度更大,所以溶液的酸性越强,
故答案为:K值越大电离出的氢离子浓度越大,所以酸性越强;
(3)电离平衡常数越大的酸性越强,越小的酸性越弱,根据表格知,酸性增强的是H3PO4,最弱的是 HPO42-,
故答案为:H3PO4;HPO42-;
(4)由表中H3PO4的电离常数可知,同一多元弱酸的K1、K2、K3之间存在着数量上的规律:K1:K2:K3≈1:10-5:10-10,多元弱酸分步电离,第一步电离程度最大,第二步、第三步依次减小,原因是上一级电离产生的H+对下一级电离有抑制作用,
故答案为:K1:K2:K3≈1:10-5:10-10;上一级电离产生的H+对下一级电离有抑制作用;
(5)Na2CO3溶液中碳酸根离子水解显碱性,其水解离子方程式为:CO32-+H2O?HCO3-+OH-;
故答案为:碱性;CO32-+H2O?HCO3-+OH-;
(6)NaH2PO4溶液中H2PO4-既水解又电离,以电离为主,H2PO4-水解生成H3PO4,电离生成HPO42-,所以该溶液中c(H3PO4)小于c(HPO42-)
故答案为:小于.
点评 本题考查了弱电解质的电离、电离常数的应用、盐的水解原理的应用,题目难度不大,把握酸的电离程度越小,其酸性越弱,则其酸根离子的水解程度越大是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 3:2 | B. | 2:3 | C. | 1:1 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 | |
| B. | 没有单质参加的反应一定不是氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | 化合反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
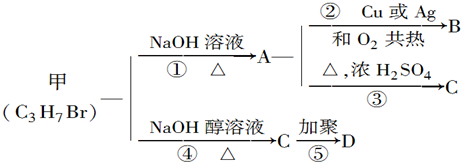
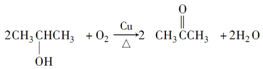

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将H2SO4溶液改为浓硫酸 | |
| B. | 用1mol/LH2SO4溶液代替原H2SO4溶液 | |
| C. | 用锌粉代替块状锌 | |
| D. | 用同浓度热的H2SO4溶液代替原H2SO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量碳酸钠粉末 | B. | 加入少量硫酸铜溶液 | ||
| C. | 加入适量NaCl溶液 | D. | 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验内容 | 实验现象 |
| 向2mL维生素C溶液中滴加2滴紫色石蕊试液 | 溶液变为红色 |
| 将维生素C的溶液逐滴加入到2mL溶有淀粉的碘水中 | 溶液由蓝色变为无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com