
��Ԫ�غ�±��Ԫ�ض����γɶ������ʣ����ǿ���������ѧ���ʽṹ�����ʵ����֪ʶȥ��ʶ�����⡣
��1����ļ۵����Ų�ʽΪ ��PCl3�Ŀռ乹��Ϊ
��2����֪CsICl2���ȶ��������ֽ⣬���������ɾ����ܸ�������ʣ����������� ʽ������
A�� CsICl2=CsCl+ICl B�� CsICl2=CsI+Cl2
��3�������±��ṩ�ĵ�һ�����������жϣ����п������ɽ��ȶ��ĵ��������ӵ�±��ԭ����___________��
�� | �� | �� | �� | |
��һ������(kJ•mol��1) | 1681 | 1251 | 1140 | 1008 |
��4�����з��ӼȲ�����s��p�Ҽ���Ҳ������p��p�м�����
A�� HCl B��HF C�� SO2 D�� SCl2
��5����֪COCl2Ϊƽ���Σ���COCl2����̼ԭ�ӵ��ӻ��������Ϊ ��д��CO�ĵȵ�������� (д��1��)��
��6������������ȼ��ʱ�õ�һ�ָƵ������ᄃ�壬��ṹ��ͼ��ʾ���ɴ˿��жϸøƵ�������Ļ�ѧʽΪ ����֪����������ܶ��Ǧ�g•cm��3���������������������Ӽ�ľ���Ϊ cm(ֻҪ������ʽ�����ؼ������ֵ�������ӵ�����ΪNA)��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�������˫Ѽɽһ�и߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����ºϳ�·�ߣ�������ת��Ϊ����

��������������ǣ� ��
A�����裨2�������п��ܺ���δ��Ӧ�ļף�������ˮ�����Ƿ�
B����Ӧ��1�������Լ���Һ�壬��������
C���ͱ�����������KMnO4��Һ������Ӧ
D���Ҽ��ܷ���ˮ�ⷴӦ�����ܷ�����ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꽭��ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������ʵ���Һ�У�������֧���Ե缫ֱͨ����һ��ʱ�����Һ��pH�������
A��AgNO3 B��H2SO4 C��NaOH D��Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�캣��ʡ�����߿���ǰģ��ʮ����ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���0.10mol/LNaOH��Һ�ֱ�ζ�20.00mL0.10mol/L��HA��HB��Һ���ζ���������ͼ��ʾ������˵���������( )
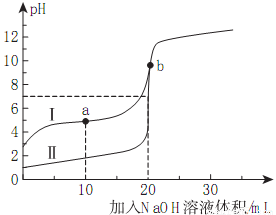
A���������HB��b��ʱ��ϵ���У�c(B-)+c(HB)=0.05mol/L
B���ζ������У����Ȳ��������ζ����ߢ��е�ָʾ��
C��a��ʱ����Һ������Ũ��������c(Na+)
D���������HA�ĵζ����ߣ���Ka(HB)��10-5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�캣��ʡ�����߿���ǰģ��ʮ����ѧ�Ծ��������棩 ���ͣ�ѡ����
��������һ�ֳ��õ�ҽҩ�м��壬��ṹ��ͼ��ʾ��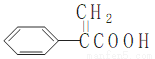 �������й�˵���д������( )
�������й�˵���д������( )
A���嵥�����밢���ᷢ���ӳɷ�Ӧ
B���������������ᷢ��ȡ����Ӧ
C����������KMnO4��Һ���������뱽
D������������к���4��̼̼˫��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ���ٴ����и������������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£�Ũ�Ⱦ�Ϊ0.10 mol/L�������ΪV0��HA��HB��Һ���ֱ��ˮϡ�������V��pH�� �ı仯��ͼ��ʾ������������ȷ����( )
�ı仯��ͼ��ʾ������������ȷ����( )

A�����¶���HB�ĵ���ƽ�ⳣ��Լ����1.11��10��5
B����ͬ������NaA��Һ��pH����NaB��Һ��pH
C����Һ��ˮ�ĵ���̶ȣ�a��c��b
D���� ʱ��������Һͬʱ�����¶ȣ���
ʱ��������Һͬʱ�����¶ȣ��� ��С
��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�츣��ʡ������ѧ���ܿ��������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
��ͭ������ͭ������Ҫ�����Ұ������ױ����Ϊ�ƽ��ֳ����˽�
��1����CuSO4��Һ�м�������İ�ˮ��������[Cu(NH3)4]SO4������˵����ȷ����
A.������������ˮ������ΪNH3���Ӻ�ˮ����֮���γ�3�ֲ�ͬ�����
B.[Cu(NH3)4]SO4���Ԫ���С�N��O��S��һ�����ܴ�С˳����O>N>S
C. [Cu(NH3)4]SO4�����еĻ�ѧ�������Ӽ������Լ�����λ��
D. NH3���Ӻ�H2O���ӵĿռ乹�Ͳ�ͬ���Ұ������ӵļ���С��ˮ���ӵļ���
��2��Teλ�����ڱ���__________�壬H2Te��H2S�е�__________(��ߡ��͡�)��ij���ڼ���̬��Sԭ�ӣ�����1��3s����ԾǨ��3p����У��ü���̬Sԭ�ӵĺ�������Ų�ʽΪ__________��
��3��S��+4��+6���ּ�̬��������ش��������⣺
�����й�����̬SO3��SO2��˵���У���ȷ����__________
A������ԭ�ӵļ۲���Ӷ���Ŀ��� B�����Ǽ��Է���
C������ԭ�ӵŶԵ�����Ŀ��� D�������м��Լ�
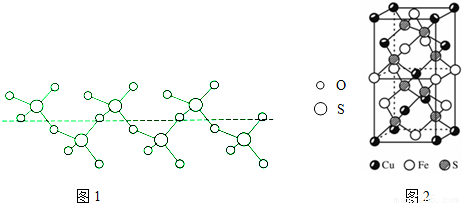
�ڽ���Һ̬SO3��ȴ��289.8Kʱ���̵õ�һ������״�����ṹ�Ĺ��壬��ṹ��ͼ1���˹�̬SO3��Sԭ�ӵ��ӻ����������__________��
��4��Cu��+1��+2���ּ�̬�Ļ�����ش��������⣺
��Cu+�ļ۲���ʾ��ͼΪ__________��Cu2+��__________��δ�ɶԵ��ӣ�
�����Ƶ�Cu(OH)2�ܹ��ܽ��ڹ���Ũ����Һ�У���Ӧ�����ӷ���ʽ��
��5��CuFeS2�ľ�����ͼ2��ʾ����������a=0.524nm��c=1.032nm��CuFeS2�ľ�����ÿ��Cuԭ����__________��Sԭ����������ʽ���㾧���ܶ� ��= __________g•cm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�찲��ʡ�����и������ۺ�ѵ��ʮ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����£���������������ʵ���Ũ�ȵ�NH4HCO3��NaCl��Һ��ϣ���������NaHCO3���壬���ˣ�������ҺpH<7������˵������ȷ����
A��������˵����NaHCO3������ˮ
B����Һ�е�c(Na+)��c(HCO3��)��c(CO32��)��c(H2CO3)
C����Һ��c(Na+)+c(H+)+c(NH4+)= c(OH��)+ c(HCO3��)+c(CO32��)
D����Һ��c(Cl��)>c(NH4+)> c(HCO3��)> c(H+)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ������
��֪A��B��C��D��E�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵����A��B��C��D��E������A��B��C��ͬһ���ڵķǽ���Ԫ�ء�������DCΪ���ӻ����D�Ķ�����������C�������Ӿ�����ͬ�ĵ��Ӳ�ṹ��AC2Ϊ�Ǽ��Է��ӡ�B��C���⻯��ķе������ͬ����������Ԫ���⻯��ķе�ߡ�E��ԭ������Ϊ24��ECl3����B��C���⻯���γ�����λ��������������������ʵ���֮��Ϊ2��1������������λ����硣���������������ش��������⣺(����ʱ��A��B��C��D��E������Ӧ��Ԫ�ط��ű�ʾ)
��1��A��B��C�ĵ�һ��������С�����˳��Ϊ________��
��2��B���⻯��ķ��ӿռ乹����________��������ԭ�Ӳ�ȡ________�ӻ���
��3��һ����B��C��ɵĻ�������AC2��Ϊ�ȵ����壬�仯ѧʽΪ________��
��4��ECl3�γɵ������Ļ�ѧʽΪ________��
��5��B������������Ӧ��ˮ�����ϡ��Һ��D�ĵ��ʷ�Ӧʱ��B����ԭ����ͼۣ��÷�Ӧ�Ļ�ѧ����ʽ��______________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com