
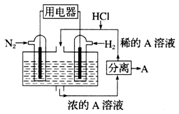
 科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )
科学家设想,N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能又能固氮的新型燃料电池,装置如图所示.下列说法不正确的是( )| A. | A为NH4Cl | |
| B. | 反应过程中溶液的pH会变大,故需要加入盐酸 | |
| C. | 该电池外电路电子从通入N2的电极流向通入H2的电极 | |
| D. | 通入N2的电极发生的电极反应式为N2+6e-+8H+=2NH+ |
分析 以N2、H2为原料,以溶有A的稀盐酸为电解质溶液构成新型燃料电池,正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+;负极是氢气失电子生成氢离子,电极方程式为H2-2e-=2H+,以此解答该题.
解答 解:A.根据负极电极反应为:H2-2e-=2H+,正极电极反应N2+8H++6e-═2NH4+,总反应式为N2+3H2+2H+=2NH4+,则H2为负极,A为NH4Cl,故A正确;
B.放电过程中,负极电极反应为:H2-2e-=2H+,正极电极反应N2+8H++6e-═2NH4+,总反应式为N2+3H2+2H+=2NH4+,消耗氢离子,电解质溶液PH升高,故需要加入盐酸,故B正确;
C.N2为正极,H2为负极,外电路电子从通入H2的电极流向通入N2的电极,故C错误;
D.正极发生还原反应,即氮气被还原生成NH4+,电极反应式为N2+6e-+8H+=2NH4+,故D正确.
故选C.
点评 本题考新型燃料电池,为高频考点,侧重于学生的分析能力的考查,注意根据总反应式判断出正负极的反应,从化合价变化的角度分析,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数为K12/K2 | |
| B. | 平衡后c(Cl2)=2.5×10-2mol/L | |
| C. | 其它条件保持不变,反应在恒压条件下进行,则平衡常数K2增大 | |
| D. | 平衡时NO2的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯具有强氧化性,可用来漂白织物 | |
| B. | 氯化铝是强电解质,可电解其水溶液获得金属铝 | |
| C. | 石英坩埚耐高温,可用来加热熔化烧碱、纯碱等固体 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
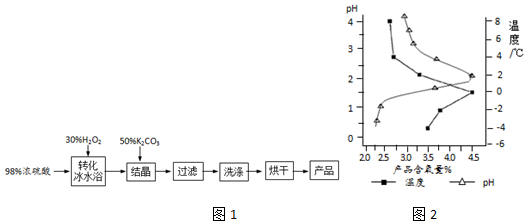
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提出了元素周期律 | B. | 提出了杂化轨道理论 | ||
| C. | 发现了电子 | D. | 发现了能量最低原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| B. | 某雨水样品放置一段时间后,pH由4.68变为4.00,是因为水中溶解的CO2增多 | |
| C. | 药皂中含有的苯酚具有强氧化性,能杀菌消毒 | |
| D. | 胶体具有介稳性的主要原因是因胶体粒子所作的布朗运动使它们不容易聚集成质量较大的颗粒而沉降下来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
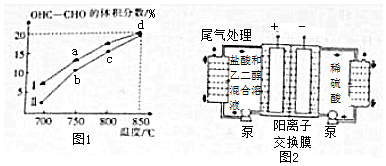
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯中混有浓硝酸,加入足量稀NaOH溶液洗涤,振荡,用分液漏斗分液 | |
| B. | 乙烯中混有SO2、CO2,将其通入NaOH溶液洗气 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸氢钠溶液的洗气瓶 | |
| D. | 乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com