
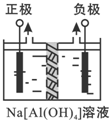
 Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题:
Al2O3、Al(OH)3都是重要化工原料.根据要求回答问题:分析 (1)电解本质是电解水,阴极上水放电生成氢气与氢氧根离子,阳极上水放电生成生成氧气与氢离子,氢离子再与[Al(OH)4]-反应生成Al(OH)3;
(2)根据电子转移守恒计算生成氧气物质的量,再根据方程式计算生成Al(OH)3的物质的量;
(3)胶体微粒直径在1nm~100nm之间;
(4)用KSCN溶液检验溶液中Fe3+;
(5)过氧化氢具有强氧化性,将Fe2+氧化为Fe3+,再调节溶液pH,使Fe3+转化氢氧化铁沉淀,过滤除去;
(6)加入X能与氢离子反应,调节溶液pH,使Fe3+转化氢氧化铁沉淀,过滤除去,但不能引入新的杂质离子;根据离子开始沉淀及沉淀完全的pH分析溶液的pH偏离3.5可能带来的后果.
解答 解:(1)电解本质是电解水,阴极上水放电生成氢气与氢氧根离子,阳极上水放电生成生成氧气与氢离子,氢离子再与[Al(OH)4]-反应生成Al(OH)3,故产物Al(OH)3在阳极区沉积,
故答案为:阳极;
(2)根据电子转移守恒,生成氧气物质的量为$\frac{2mol}{4}$=0.5mol,由:4Na[Al(OH)4]+2H2O $\frac{\underline{\;通电\;}}{\;}$4Al(OH)3↓+4NaOH+O2↑+2H2↑,可知生成Al(OH)3的物质的量为0.5mol×4=2mol,
故答案为:2;
(3)胶体微粒直径在1nm~100nm之间,则纳米氧化铝的直径约为10-9~10-7m,
故答案为:10-9~10-7;
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是:加KSCN溶液,溶液变血红色,
故答案为:加KSCN溶液,溶液变血红色;
(5)过氧化氢具有强氧化性,将Fe2+氧化为Fe3+,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(6)加入X能与氢离子反应,调节溶液pH,使Fe3+转化氢氧化铁沉淀,过滤除去,CuO、NaOH、NaHCO3均为引入杂质离子,故选Al(OH)3,
若调节后溶液的pH偏离3.5,pH过小Fe3+沉淀不完全,pH过大Al3+可能因沉淀而损失,
故答案为:B;pH过小Fe3+沉淀不完全,pH过大Al3+可能因沉淀而损失.
点评 本题考查物质制备实验,涉及电解原理、离子检验、对试剂及条件控制的分析评价,是对学生综合能力的考查,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 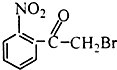 | B. | 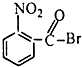 | C. | 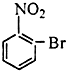 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x<n时,钠生成的氢气最多 | B. | x=n时,钠、镁、铝生成的氢气一样多 | ||
| C. | n<x≤2n时,生成的氢气钠<镁=铝 | D. | x≥2n时,生成的氢气钠<镁<铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | sp | B. | sp2 | C. | sp3 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
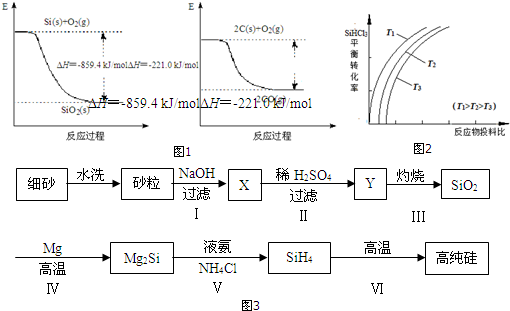
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X原子的最外层电子数比Y原子的最外层电子数多 | |
| B. | 原子半径:X>Y | |
| C. | 1mol X从酸中置换出来的氢比1mol Y从酸中置换出来的氢多 | |
| D. | X原子的最高正化合价比Y原子的最高正化合价高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应来制取并收集氯气,实验装置如图所示.
某校化学兴趣小组利用在加热条件下浓盐酸与二氧化锰的反应来制取并收集氯气,实验装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
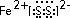 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com