
| A. | 1.2mol/L | B. | 1.5mol/L | C. | 1.6mol/L | D. | 2.0mol/L |
分析 还原性强弱:I->Fe2+,氯气先氧化碘离子,再氧化亚铁离子;碘离子完全氧化后,溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,发生反应离子方程式为:Cl2+2Fe2+=2Cl-+Fe3+;设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c、c(Fe2+)=cmol/L,所以与碘离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$n(I-)=$\frac{1}{2}$×2c•V=0.1c mol;反应完成后溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$×$\frac{1}{2}$n(Fe2+)=$\frac{1}{4}$cV=0.025cmol,最后结合消耗氯气的总物质的量列式计算即可.
解答 解:还原性强弱:I->Fe2+,往100mL碘化亚铁溶液中缓慢通入4.48L(标准状况)氯气,氯气先氧化碘离子,再氧化亚铁离子,已知氯气的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,发生反应离子方程式为:Cl2+2I-=2Cl-+I2,
碘离子完全氧化后,溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,发生反应离子方程式为:Cl2+2Fe2+=2Cl-+Fe3+,
设原碘化亚铁溶液的物质的量浓度为cmol/L,则c(I-)=2c(FeI2)=2c、c(Fe2+)=cmol/L,
所以与碘离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$n(I-)=$\frac{1}{2}$×2c•V=0.1c mol,
反应完成后溶液中有$\frac{1}{2}$的Fe2+被氧化成Fe3+,则与亚铁离子反应消耗的氯气为n(Cl2)=$\frac{1}{2}$×$\frac{1}{2}$n(Fe2+)=$\frac{1}{4}$cV=0.025cmol,
所以0.025cmol+0.1cmol=0.2mol
解得c=1.6mol/L,
故选C.
点评 本题主要考查学生氧化还原反应的有关计算,为高频考点,题目难度中等,侧重于学生的分析能力和计算能力来的考查,明确溶液中离子反应的先后顺序为解答关键.


科目:高中化学 来源: 题型:解答题
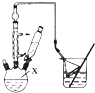 对叔丁基苯酚
对叔丁基苯酚 工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下:
工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.实验步骤如下:反应物和产物的相关数据列表如下: .该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.
.该反应过于激烈,放出大量热,常使实验的产率降低,可能的原因是由于叔丁基氯挥发导致产率降低.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
| 实验次数 温度 | 起始温度t1/℃ | 终止温度t2/℃ | 平均温度差(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除了③ | B. | ①②④ | C. | ③⑤ | D. | 除了⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高分子化合物结构复杂,相对分子质量很大 | |
| B. | 对于一块高分子材料来说,n是一个整数,因而它的相对分子质量是确定的 | |
| C. | 高分子化合物是纯净物 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅是制造太阳能电池的常用材料 | |
| B. | 光导纤维的主要成分是硅 | |
| C. | 用氢氟酸可以蚀刻玻璃 | |
| D. | 石灰石和粘土是制玻璃的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- | |
| B. | 有NO3-存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br- | |
| C. | 碳酸氢钠溶液中:K+、ClO-、Cl-、OH- | |
| D. | 使酚酞变红的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com