

分析 (1)比较酸性强弱,可根据强酸制备弱酸、测定等浓度的pH以及溶液的导电能力判断;
(2)系统(Ⅰ)涉及水的分解,系统(Ⅱ)涉及硫化氢的分解,利用盖斯定律分别将系统(Ⅰ)和系统(Ⅱ)的热化学方程式相加,可得到水、硫化氢分解的热化学方程式;
(3)对于反应H2S(g)+CO2(g)?COS(g)+H2O(g)
起始(mol)0.40 0.10 0 0
转化(mol)x x x x
平衡(mol)0.40-x 0.10-x x x
反应平衡后水的物质的量分数为0.02,
则$\frac{x}{0.50}$=0.02,x=0.01,结合平衡移动的影响因素解答该题.
解答 解:(1)A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以,符合强酸制备弱酸的特点,可说明亚硫酸的酸性比氢硫酸强,故A正确;
B.氢硫酸的导电能力低于相同浓度的亚硫酸,可说明亚硫酸的电离程度大,则亚硫酸的酸性强,故B正确;
C.0.10mol•L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1,可说明亚硫酸的电离程度大,酸性较强,故C正确;
D.氢硫酸的还原性强于亚硫酸,不能用于比较酸性的强弱,故D错误.
故答案为:D;
(2)系统(Ⅰ)涉及水的分解,系统(Ⅱ)涉及硫化氢的分解,利用盖斯定律分别将系统(Ⅰ)和系统(Ⅱ)的热化学方程式相加,可得到水、硫化氢分解的热化学方程式,则系统(I)的热化学方程式H2O(l)=H2(g)+$\frac{1}{2}$O2(g)△H=+286kJ/mol;
系统(II)的热化学方程式H2S (g)+=H2(g)+S(s)△H=+20kJ/mol.
根据系统I、系统II的热化学方程式可知:每反应产生1mol氢气,后者吸收的热量比前者少,所以制取等量的H2所需能量较少的是系统II.
故答案为:H2O(l)=H2(g)+$\frac{1}{2}$O2(g)△H=+286kJ/mol;H2S (g)+=H2(g)+S(s)△H=+20kJ/mol;系统(Ⅱ);
(3)对于反应H2S(g)+CO2(g)?COS(g)+H2O(g)
起始(mol)0.40 0.10 0 0
转化(mol)x x x x
平衡(mol)0.40-x 0.10-x x x
反应平衡后水的物质的量分数为0.02,
则$\frac{x}{0.50}$=0.02,x=0.01,
①H2S的平衡转化率a1=$\frac{0.01}{0.4}×100%$=2.5%,
体积为2.5L,则平衡时各物质的浓度为c(H2S)=$\frac{0.4-0.01}{2.5}$mol/L=0.156mol/L,c(CO2)=$\frac{0.1-0.01}{2.5}$mol/L=0.036mol/L,c(COS)=c(H2O)=$\frac{0.01}{2.5}$mol/L=0.004mol.L,
则K=$\frac{0.004×0.004}{0.156×0.036}$=0.00285,
故答案为:2.5;0.00285;
②根据题目提供的数据可知温度由610K升高到620K时,化学反应达到平衡,水的物质的量分数由0.02变为0.03,所以H2S的转化率增大,a2>a1;根据题意可知:升高温度,化学平衡向正反应方向移动,根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,所以该反应的正反应为吸热反应,故△H>0,
故答案为:>;>;
③A.增大H2S的浓度,平衡正向移动,但加入量远远大于平衡移动转化消耗量,所以H2S转化率降低,故A错误;
B.增大CO2的浓度,平衡正向移动,使更多的H2S反应,所以H2S转化率增大,故B正确;
C.COS是生成物,增大生成物的浓度,平衡逆向移动,H2S转化率降低,故C错误;
D.N2是与反应体系无关的气体,充入N2,不能使化学平衡发生移动,所以对H2S转化率无影响,故D错误.
故答案为:B.
点评 本题为2017年考题,题目考查较为综合,涉及元素周期律、热化学方程式以及化学平衡的影响因素和计算等问题,综合考查学生的分析能力和计算能力,注意把握盖斯定律的应用以及化学平衡三段式的计算方法,难度中等.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 中子数为18的硫原子:${\;}_{16}^{34}$S | B. | S2-的结构示意图: | ||
| C. | 过氧化氢的电子式:H+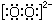 H+ H+ | D. | 葡萄糖的结构简式:C6H12O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
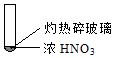 | 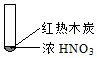 | 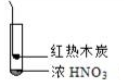 |
| ① | ② | ③ |
| A. | 由①中的红棕色气体,推断产生的气体一定是混合气体 | |
| B. | 红棕色气体不能表明②中木炭与浓硝酸产生了反应 | |
| C. | 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物 | |
| D. | ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加c(CO),平衡向正向移动,反应的平衡常数增大 | |
| B. | 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃ | |
| C. | 第二阶段,Ni(CO)4分解率较低 | |
| D. | 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
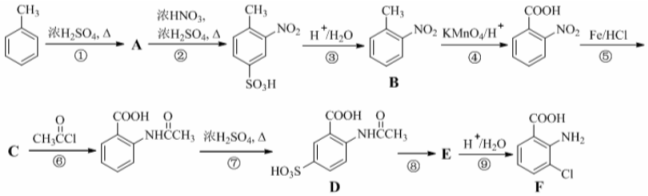

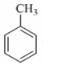 分子中不同化学环境的氢原子共有4种,共面原子数目最多为13.
分子中不同化学环境的氢原子共有4种,共面原子数目最多为13.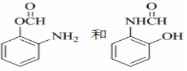 .
. ,该步反应的主要目的是保护氨基.
,该步反应的主要目的是保护氨基.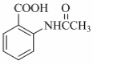 为主要原料,经最少步骤制备含肽键聚合物的流程.
为主要原料,经最少步骤制备含肽键聚合物的流程.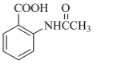 …$→_{反应条件}^{反应试剂}$目标化合物 …$→_{反应条件}^{反应试剂}$目标化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 电解饱和食盐水获取烧碱和氯气:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向氢氧化钡溶液中加入稀硫酸:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
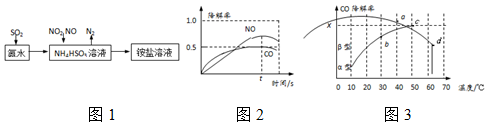
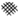 ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围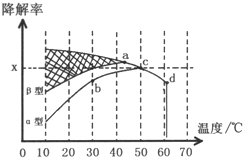 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com