
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,回答下列问题:
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g) △H1 = +48kJ/mol
4SiHCl3(g) = SiH4(g) + 3SiCl4(g) △H3 = +114kJ/mol
则反应3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H=______________kJ/mol。
(2)对于反应2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g),采用合适的催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。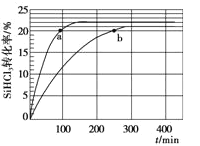
①比较a、b处反应速率大小:υa_____υb(填“>”、“<”、“=”)
②在343 K下:要缩短反应达到平衡的时间,可采取的措施有____。
A、增大反应物浓度
B、增大压强
C、及时将产物从体系分离
D、使用更高效的催化剂
③某温度(T K)下,该反应可使SiHCl3的平衡转化率达到30%,则该温度下的平衡常数KT K___K343 K(填“>”、“<”、“=”),已知反应速率υ=υ正-υ逆=k正x2(SiHCl3)-k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在该温度下当转化率为20%的时刻,υ正/υ逆=________(保留1位小数)。
【答案】-30 > ABD > 2.9
【解析】
(1)根据盖斯定律计算3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H;
(2)根据图示,a点所在的曲线 达到平衡用时少,说明a点所在的曲线温度高;要缩短反应达到平衡的时间,应加快反应速率;
③根据图示,343 K时的平衡转化率是22%,T K时该反应可使SiHCl3的平衡转化率达到30%,说明343 K→T K平衡正向移动;该温度下,反应平衡时υ正=υ逆,根据SiHCl3的平衡转化率为30%,计算![]() 。
。
(1) ①2SiHCl3(g) = SiH2Cl2(g) +SiCl4(g) △H1 = +48kJ/mol;
②4SiHCl3(g) = SiH4(g) + 3SiCl4(g) △H3 = +114kJ/mol
根据盖斯定律②-①×3得3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H= +114kJ/mol- 48kJ/mol×3= -30kJ/mol。
(2)①a、b两点的转化率相等,各物质浓度相等, a点所在的曲线温度高,所以反应速率大小:υa>υb;
②A、增大反应物浓度,反应速率加快,能缩短反应达到平衡的时间,故选A;
B、增大压强,反应速率加快,能缩短反应达到平衡的时间,故选B;
C、及时将产物从体系分离,浓度减小,反应速率减慢,能延长反应达到平衡的时间,故不选C;
D、使用更高效的催化剂,反应速率加快,能缩短反应达到平衡的时间,故选D;
③根据图示,343 K时的平衡转化率是22%,T K时该反应可使SiHCl3的平衡转化率达到30%,说明343 K→T K平衡正向移动;所以KT K>K343 K;
该温度下,反应平衡时υ正=υ逆,SiHCl3的平衡转化率为30%,平衡时
2SiHCl3(g) = SiH2Cl2(g) +SiCl4(g)
起始 a 0 0
转化 0.3a 0.15a 0.15a
平衡 0.7a 0.15a 0.15a
k正x2(SiHCl3)= k逆x(SiH2Cl2)x(SiCl4),k正![]() =k逆
=k逆![]() ,
,![]() ;
;
该温度下当转化率为20%的时刻,
2SiHCl3(g) = SiH2Cl2(g) +SiCl4(g)
起始 a 0 0
转化 0.2a 0.1a 0.1a
平衡 0.8a 0.1a 0.1a
υ正/υ逆=![]() 2.9。
2.9。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】Cu2+能与NH3、H2O、OH﹣、Cl﹣等形成配位数为4的配合物。
(1)向CuSO4溶液中加入过量NaOH溶液可生成Na2[Cu(OH)4]。
①画出配离子[Cu(OH)4]2+中的配位键__。
②Na2[Cu(OH)4]中除了配位键外,还存在的化学键类型有__(填序号)。
A.离子键 B.金属键 C.极性共价键 D.非极性共价键
(2)金属铜单独与氨水或过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液发生如下反应:Cu+H2O2+4NH3═[Cu(OH)4]2++2OH﹣。其原因是_________________.
(3)Cu2+可以与乙二胺(H2N﹣CH2CH2﹣NH2)形成配离子(如图):

①H、O、N三种元素的电负性从大到小的顺序____。
②乙二胺分子中N原子成键时采取的杂化类型是__。
③乙二胺沸点高于Cl﹣CH2CH2﹣Cl的主要原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】华法林(Warfarin)又名杀鼠灵,被美国食品药品监督管理局批准为心血管疾病的临床药物。其合成路线(部分反应条件略去)如下所示:
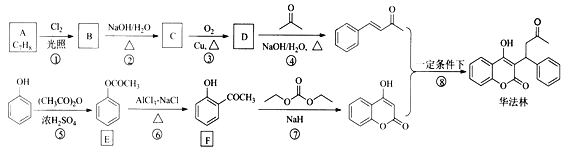
回答下列问题:
(1)A的名称为_______,E中官能团名称为________。
(2)B的结构简式为________。
(3)由C生成D的化学方程式为_________
(4)⑤的反应类型为______,⑧的反应类型为_________。
(5)F的同分异构体中,同时符合下列条件的同分异构体共有__________种。
a.能与FeCl3溶液发生显色反应 b.能发生银镜反应
其中核磁共振氢谱为五组峰的结构简式为_________。
(6)参照上述合成路线,设计一条由苯酚(![]() )、乙酸酐(CH3CO)2O和苯甲醛(
)、乙酸酐(CH3CO)2O和苯甲醛(![]() )为原料,制备
)为原料,制备 的合成路线(其他无机试剂任选)_____。
的合成路线(其他无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关滴定的说法正确的是( )
A. 用25mL滴定管进行中和滴定时,用去标准液的体积为21.7mL
B. 用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中有NaOH杂质,则结果偏低
C. 用C1mol/L酸性高锰酸钾溶液滴定V2mL未知浓度的H2C2O4溶液,至滴定终点用去酸性高猛酸钾溶液体积为V1mL,则H2C2O4溶液的浓度为![]() mol/L
mol/L
D. 用未知浓度的盐酸滴定已知浓度的NaOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
k=__________________________。
(3)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:

①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在P压强条件下进行,则M点的分压平衡常数KP=________(用含P的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_______点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水杨酸(结构如图所示)为柳树皮提取物之一,是一种天然的消炎药,主要作为医药工业的原料。下列关于水杨酸的叙述错误的是( )
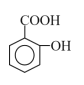
A.分子式为C7H6O3
B.能发生加成、酯化、中和等反应
C.苯环上的二氯取代物有5种
D.所有原子均可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,H2(g)+CO2(g) ![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() ,该温度下在甲、乙、丙、丁四个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
,该温度下在甲、乙、丙、丁四个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
起始浓度 | 甲 | 乙 | 丙 | 丁 |
c(H2)/mol·L-1 | 0.010 | 0.020 | 0.01 | 0.020 |
c(CO2)/mol·L-1 | 0.010 | 0.010 | 0.02 | 0.020 |
下列判断不正确的是
A.平衡时,丙中CO2的转化率小于60%
B.平衡时,甲中和丁中H2的转化率均是60%
C.平衡时,乙中H2和丙中CO2的物质的量浓度相同,均为0.014 mol·L-1
D.平衡时,乙中和丙中CO的体积分数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素![]() 原子序数依次增大,X均能与其他三种元素形成共价化合物。四种元素组成某正盐M的水溶液遇到三价铁离子时,呈现血红色。下列说法错误的是( )
原子序数依次增大,X均能与其他三种元素形成共价化合物。四种元素组成某正盐M的水溶液遇到三价铁离子时,呈现血红色。下列说法错误的是( )
A.M遇到浓氢氧化钠溶液时,会产生使蓝色石蕊试纸变红的气体
B.Y的某种氢化物可做植物生长调和剂,催熟水果
C.Z的氧化物对应水化物可能是弱酸
D.化合物(WYZ)2中所有原子均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com